БАД серии ЛИТОВИТ в каталоге >>>
- ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ И ПЕРЕНОСИМОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» ПРИ ОДНОКРАТНОМ ВВЕДЕНИИ ЛАБОРАТОРНЫМ ЖИВОТНЫМ РАЗЛИЧНЫХ ВИДОВ
- ИЗУЧЕНИЕ ТОКСИЧНОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» ПРИ ТРЕХКРАТНОМ ВВЕДЕНИИ МЫШАМ И КРЫСАМ В ВЫСОКИХ ДОЗАХ
- ИЗУЧЕНИЕ ТОКСИЧНОСТИ СУБСТАНЦИИ «ЛИТОВИТ-М» В УСЛОВИЯХ 6- МЕСЯЧНОГО ХРОНИЧЕСКОГО ЭКСПЕРИМЕНТА НА КРЫСАХ
- ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» В УСЛОВИЯХ ТРЕХМЕСЯЧНОГО ХРОНИЧЕСКОГО ЭКСПЕРИМЕНТА НА СОБАКАХ.
- ИЗУЧЕНИЕ МУТАГЕННЫХ СВОЙСТВ БАД К ПИЩЕ «ЛИТОВИТ-М»
- ИССЛЕДОВАНИЕ ЦИТОГЕНЕТИЧЕСКОЙ АКТИВНОСТИ «ЛИТОВИТА-М» МЕТОДОМ УЧЕТА ХРОМОСОМНЫХ АБЕРРАЦИЙ В КЛЕТКАХ КОСТНОГО МОЗГА МЫШЕЙ.
- ИЗУЧЕНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА ИНДУКЦИЮ ДОМИНАНТНЫХ ЛЕТАЛЬНЫХ МУТАЦИЙ В ЗАРОДЫШЕВЫХ КЛЕТКАХ МЫШЕЙ.
- ИССЛЕДОВАНИЕ ЭМБРИОТОКСИЧЕСКИХ И ТЕРАТОГЕННЫХ СВОЙСТВ «ЛИТОВИТА-М»
- ИЗУЧЕНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА РЕПРОДУКТИВНУЮ ФУНКЦИЮ.
- ИЗУЧЕНИЕ АЛЛЕРГИЗИРУЮЩИХ СВОЙСТВ «ЛИТОВИТА-М»
- ИССЛЕДОВАНИЕ ИММУНОТОКСИЧЕСКИХ СВОЙСТВ БАД К ПИЩЕ «ЛИТОВИТ-М»
- ЗАКЛЮЧЕНИЕ О БЕЗОПАСНОСТИ БАД к пище «ЛИТОВИТ-М»
Российский кардиологический научно – производственный комплекс Министерства здравоохранения РФ, Научно – исследовательский институт экспериментальной кардиологии, лаборатория лекарственной токсикологии, отчет: «О доклиническом токсикологическом изучении «Литовита-М», д.м.н. Арзамасцев Е. В., Москва, 2000 г.
Программа токсикологического исследования включала: изучение токсичности и переносимости «Литовит-М» при однократном введении лабораторным животным, изучение токсичности «Литовит-М» в условиях 6 – месячного хронического эксперимента на крысах и 3 – месячного хронического эксперимента на собаках.
Кроме того, было проведено изучение потенциальных мутагенных, эмбриотоксических, тератогенных, аллергизирующих и иммунотоксических свойств БАД к пище «Литовит-М», а также его влияние на репродуктивную функцию.
В результате проведенных исследований установлено, что при однократном введении лабораторным животным «Литовит-М» является практически нетоксичным веществом.
При изучении токсичности «Литовита-М» при 6 – месячном введении в желудок крысам в дозах 1,5 и 3,0 г/кг (20- и 40- кратные терапевтические дозы, рекомендованные для человека) и собакам в дозе 1,05 г/кг (15- кратная рекомендуемая доза для человека) не установлено повреждающего действия препарата на основные органы и системы подопытных животных.
«Литовит-М» не обладает мутагенными свойствами. В испытанной дозе 1,5 г/кг «Литовит-М» не проявляет эмбриотоксического и тератогенного эффектов, не оказывает влияния на репродуктивную функцию.
В испытанных дозах и схемах введения «Литовит-М» не обладает аллергизирующими и иммунотоксическими свойствами.
ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ И ПЕРЕНОСИМОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» ПРИ ОДНОКРАТНОМ ВВЕДЕНИИ ЛАБОРАТОРНЫМ ЖИВОТНЫМ РАЗЛИЧНЫХ ВИДОВ
Изучение токсичности субстанции «Литовита-М» при однократном введении проведено на 70 мышах BALB/c (самцы и самки, масса тела 18 – 20 г) и 42 крысах Wistar (самцы и самки, масса тела 180 – 200 г).
В связи с практической нерастворимостью «Литовита-М» в воде, исследование токсичности при однократном введении указанным видам животных проведено только при назначении препарата в желудок в виде взвеси на 1% крахмальном геле.
Длительность наблюдения за подопытными животными после внутрижелудочного введения препарата составляла 14 дней.
Как показали проведенные исследования, однократное введение «Литовита-М» в желудок мышам и крысам в дозах 5000 – 30000 мг/кг не вызывает каких – либо признаков интоксикации. При этом на протяжении всего периода наблюдения не было зарегистрировано гибели животных. Следует отметить, что испытанные дозы препарата 5000 – 30000 мг/кг в 70 420 раз превышают суточную дозу, рекомендованную для человека (2,5 г в сутки на человека, что составляет около 70 мг/кг).
Высшая из испытанных доз «Литовита-М» оказалась максимально возможной (по техническим причинам), которую еще можно было ввести в организм указанных видов лабораторных животных.
В связи с этим не удалось установить показателей средних смертельных доз (ЛД 50 ) «Литовита-М» для мышей и крыс при его однократном введении в желудок. Не выявлено также видовых и половых различий в чувствительности мышей и крыс к токсическому действию субстанции «Литовита-М» при данном способе введения.
Т.о., при однократном введении «Литовита-М» в желудок мышам и крысам в диапазоне испытанных доз 5000 – 30000 мг/кг установлена хорошая переносимость препарата, отсутствие симптомов интоксикации и гибели животных. Полученные данные свидетельствуют о том, что БАД к пище «Литовит-М» является практически нетоксическим веществом.
ИЗУЧЕНИЕ ТОКСИЧНОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» ПРИ ТРЕХКРАТНОМ ВВЕДЕНИИ МЫШАМ И КРЫСАМ В ВЫСОКИХ ДОЗАХ
Исследования выполнены на 28 мышах BALB/c (самцы, масса тела 18 – 20 г), которым в желудок трехкратно с интервалом 4 часа вводили «Литовит-М» в дозах 20000 мг/кг в виде взвеси на 1% крахмальном геле. Суммарная доза препарата при этом составляла 60000 мг/кг и превышала суточную терапевтическую дозу для человека (70 мг/кг) более чем в 850 раз.
В результате проведенных исследований установлено, что при трехкратном внутрижелудочном введении «Литовита-М» в дозе 20000 мг/кг с интервалом 4 часа не отмечается признаков интоксикации и гибели животных в течение 14 суток наблюдения после последнего введения препарата. При этом, однако, отмечалось угнетенное состояние мышей от механического действия переполнявших их ЖКТ второй и третьей доз изучаемого препарата.
Макроскопическое исследование внутренних органов животных, проведенное после 14 – дневного наблюдения за подопытными животными, не выявило каких – либо изменений, связанных с токсическим действием «Литовита-М».
Полученные данные подтверждают ранее установленный при изучении токсичности препарата при однократном введении животным факт о практической нетоксичности БАД к пище «Литовит-М».
ИЗУЧЕНИЕ ТОКСИЧНОСТИ СУБСТАНЦИИ «ЛИТОВИТ-М» В УСЛОВИЯХ 6- МЕСЯЧНОГО ХРОНИЧЕСКОГО ЭКСПЕРИМЕНТА НА КРЫСАХ
Изучение токсичности субстанции «Литовита-М» в условиях хронического эксперимента проведено при внутрижелудочном введении препарата крысам Wistar в течение 6 месяцев.
Условия проведения эксперимента и методы исследования
Исследования выполнены на 120 крысах Wistar (самцы и самки, первоначальная масса тела 180 – 200 г), которые были разделены на 3 группы по 40 животных в каждой: 1 группа – контроль; 2 – группа – субстанция «Литовит-М» 1,5 г/кг (20- кратная суточная доза для человека); 3 группа – субстанция «Литовит-М» 3,0 г/кг (40- кратная суточная доза для человека). При этом каждая группа животных состояла из 20 самцов и 20 самок.
Животных содержали в клетках по 5 – 7 особей в условиях искусственного освещения при температуре 20 – 22 0С и относительной влажности 60 – 65% на подстилке из древесных стружек, простерилизованных в сухожаровом шкафу. Животные получали стандартный брикетированный корм, кормление проводили в одно и тоже время. Для питья использовали поилки, воду давали без ограничений. Взвеси субстанции «Литовит-М» для внутрижелудочного введения готовили на 1% крахмальном геле. Полученные таким образом взвеси субстанции «Литовит-М» вводили внутрижелудочно животным ежедневно в течение 6 месяцев.
На протяжении эксперимента отмечали общее состояние и поведение животных (динамика массы тела, двигательная активность, аппетит, состояние шерстного покрова) – см. таблицу 4.
Таблица 4. Динамика массы тела у крыс (% к исходной) при 6- месячном внутрижелудочном введении субстанции «Литовита-М».
|
Группы животных, дозы |
Периоды наблюдения |
||
|
2 месяца |
4 месяца |
6 месяцев |
|
|
Самцы |
|||
|
Контроль |
168,4 ± 4,6 |
192,2 ± 5,6 |
209,2 ± 5,6 |
|
«Литовит-М» 1,5 г/кг |
176,5 ± 5,6 |
205,1 ± 4,3 |
226,3 ± 6,4 |
|
«Литовит М» 3,0 г/кг |
169,6 ± 5,4 |
208,5 ± 5,7 |
225,6 ± 6,8 |
|
Самки |
|||
|
Контроль |
159,8 ± 5,3 |
168,1 ± 6,2 |
199,8 ± 5,5 |
|
«Литовит-М» 1,5 г/кг |
161,6 ± 4,9 |
171,8 ± 7,0 |
193,0 ± 4,8 |
|
«Литовит М» 3,0 г/кг |
168,0 ± 6,2 |
172,4 ± 8,1 |
196,7 ± 5,4 |
До введения, а также через 2, 4 и 6 месяцев после начала введения препарата исследовали морфологический состав периферической крови (количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина), биохимические показатели (уровень общего белка, мочевины, креатина, общего билирубина, глюкозы, холестерина и триглицеридов), активность некоторых ферментов сыворотки крови (аспартат- и аланинаминотрансферазы, щелочная фосфатаза, лактатдегидрогеназа).
Для определения указанных показателей кровь у крыс брали из хвостовой вены в объеме 2,0 – 2,5 мл.
Подсчет форменных элементов крови производили на автоматическом счетчике крови «Пикоскель» (Венгрия). Уровень гемоглобина определяли гемиглобинцианидным методом.
Уровень глюкозы определяли с помощью набора фирмы «Labsystems» (Финляндия), общий белок, креатинин, мочевину и общий билирубин, а также активность лактатдегидрогеназы и щелочной фосфатаза – с помощью набора фирмы «Диаком – Синтеко» (Россия). Уровни содержания триглицеридов и холестерина определяли с помощью набора фирмы «Lachema» (Чехия). Активность аланинаминотрансферазы и аспартатаминотрансферазы – с помощью наборов фирмы «Corway» (Польша).
Биохимические показатели и активность ферментов определяли на биохимическом и полуавтоматическом анализаторе ФП-901 «Labsystems» (Финляндия).
После окончания хронического эксперимента проведена эвтаназия крыс передозировкой диэтилового эфира для патоморфологического исследования внутренних органов и тканей животных.
Вскрытие животных проводили сразу же после их гибели, по полной патологоанатомической схеме, что исключало возможный аутолиз тканей и позволяло проводить дополнительные исследования. На каждое животное составлялся полный протокол вскрытия с характеристикой патологоанатомических признаков во всех органах и системах организма.
Оценку параметров массы тела и органов животных проводили с помощью электронных весов «Сарториус» (Германия) с последующим вычислением коэффициентов массы органов и их стандартных отклонений.
Для патоморфологического исследования образцы свежей ткани фиксировали в 10% нейтрализованном растворе формалина для получения в последующем парафиновых срезов толщиной в 2 – 5 мкм. Обезвоживание, обезжиривание и проводку тканей с их уплотнением в парафинах с различной температурой плавления (37 – 570С) проводили в микропроцессорном автомате «Сакура» (Япония) по заранее составленной программе. Заливка тканей в парафин с воском и формирование тканевых блоков – ручным способом. Микротомирование парафиновых блоков тканей осуществляли с помощью санного Россия) и ротационных («Райхгерт», Австрия; «АО – 820», США) микротомов, что позволило получить серийные срезы. После депарафинирования, срезы окрашивали гематоксилин – эозином и другими азокрасителями, заключали в пихтовый (канадский) бальзам под покровные стекла и готовили для визуального просмотра постоянные микропрепараты.
Микроскопию проводили на микроскопе («Докувал», Германия).
Полученные в каждом наблюдении комплексные патоморфологические данные от получавших субстанцию «Литовит-М» крыс, сравнивали с данными контрольных животных.
Статистическую обработку всех полученных результатов проводили с помощью компьютера IBM PC/AT – 486 (Genetec).
Оценка влияния «Литовит-М» на организм крыс в условиях 6- месячного хронического эксперимента
В результате проведенных исследований установлено, что в условиях хронического эксперимента ежедневное внутрижелудочное введение субстанции «Литовита-М» в испытанных дозах 1,5 и 3,0 г/кг (20- и 40- кратная рекомендуемая доза для человека) не влияет на общее состояние и поведение крыс на протяжении всего хронического эксперимента. Животные имели гладкий шерстный покров, охотно поедали корм, сохраняли обычную двигательную активность.
На протяжении хронического эксперимента не установлено статистически значимых различий в количестве эритроцитов, лейкоцитов, тромбоцитов и уровне гемоглобина у животных, получавших субстанцию «Литовита-М» по сравнению с контролем (см. таблицы 5,6).
Таблица 5. Гематологические показатели у крыс – самцов при внутрижелудочном введении «Литовит-М» в течение 6 месяцев.
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Эритроциты, 1012/л |
|||
|
До введения (фон) |
6,6 ± 0,4 |
6,6 ± 0,5 |
6,5 ± 0,3 |
|
2 месяца |
6,5 ± 0,5 |
6,7 ± 0,4 |
6,2 ± 0,6 |
|
4 месяца |
6,7 ± 0,4 |
6,7 ± 0,5 |
6,5 ± 0,5 |
|
6 месяцев |
6,4 ± 0,4 |
6,8 ± 0,6 |
6,4 ± 0,6 |
|
Лейкоциты, 109/л |
|||
|
До введения (фон) |
9,7 ± 0,4 |
9,8 ± 0,5 |
10,0 ± 0,4 |
|
2 месяца |
10,0 ± 0,7 |
10,1 ± 0,5 |
10,5 ± 0,7 |
|
4 месяца |
9,8 ± 0,6 |
9,7 ± 0,6 |
9,7 ± 0,9 |
|
6 месяцев |
9,9 ± 0,5 |
9,6 ± 0,4 |
9,8 ± 0,6 |
|
Тромбоциты, 109/л |
|||
|
До введения (фон) |
716 ± 23 |
720 ± 21 |
731 ± 27 |
|
2 месяца |
702 ± 37 |
730 ± 35 |
745 ± 29 |
|
4 месяца |
722 ± 22 |
735 ± 29 |
724 ± 24 |
|
6 месяцев |
716 ± 28 |
706 ± 33 |
712 ± 23 |
|
Гемоглобин, г/л |
|||
|
До введения (фон) |
107 ± 5 |
106 ± 6 |
103 ± 7 |
|
2 месяца |
105 ± 4 |
103 ± 4 |
102 ± 6 |
|
4 месяца |
103 ± 5 |
107 ± 7 |
105 ± 6 |
|
6 месяцев |
105 ± 6 |
108 ± 5 |
105 ± 5 |
Таблица 6. Гематологические показатели у крыс – самок при внутрижелудочном введении «Литовит-М» в течение 6 месяцев.
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Эритроциты, 1012/л |
|||
|
До введения (фон) |
7,1 ± 0,5 |
7,0 ± 0,6 |
6,7 ± 0,4 |
|
2 месяца |
6,7 ± 0,5 |
6,4 ± 0,7 |
6,2 ± 0,3 |
|
4 месяца |
6,8 ± 0,4 |
7,0 ± 0,5 |
6,5 ± 0,6 |
|
6 месяцев |
6,8 ± 0,6 |
6,9 ± 0,4 |
6,7 ± 0,5 |
|
Лейкоциты, 109/л |
|||
|
До введения (фон) |
9,6 ± 0,5 |
9,7 ± 0,4 |
9,6 ± 0,4 |
|
2 месяца |
9,8 ± 0,4 |
9,5 ± 0,6 |
9,4 ± 0,7 |
|
4 месяца |
9,9 ± 0,4 |
9,6 ± 0,3 |
9,6 ± 0,5 |
|
6 месяцев |
9,5 ± 0,6 |
9,4 ± 0,5 |
9,8± 0,4 |
|
Тромбоциты, 109/л |
|||
|
До введения (фон) |
722 ± 20 |
731 ± 27 |
726 ± 21 |
|
2 месяца |
711 ± 24 |
722 ± 23 |
737 ± 28 |
|
4 месяца |
709 ± 28 |
717 ± 20 |
710 ± 22 |
|
6 месяцев |
719± 25 |
725 ± 27 |
724± 22 |
|
Гемоглобин, г/л |
|||
|
До введения (фон) |
100 ± 4 |
102 ± 5 |
100 ± 2 |
|
2 месяца |
98 ± 6 |
101 ± 4 |
103 ± 3 |
|
4 месяца |
103 ± 4 |
100 ± 5 |
99 ± 4 |
|
6 месяцев |
102 ± 3 |
102 ± 4 |
102 ± 5 |
В условиях хронического опыта на крысах при внутрижелудочном введении субстанции «Литовита-М» в дозах 1,5 и 3,0 г/кг не выявлено существенных изменений в уровне общего белка в сыворотке крови, что указывает на стабильность белковообразующей функции печени (см. таблицу 7).
Таблица 7. Содержание общего белка (г/л) в сыворотке крови крыс, получавших внутрижелудочно Литовит-М» в течение 6 месяцев.
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Самцы |
|||
|
До введения (фон) |
69,4 ± 2,1 |
63,2 ± 2,3 |
69,8 ± 1,9 |
|
2 месяца |
65,5 ± 1,6 |
66,3 ± 1,6 |
66,6 ± 1,4 |
|
4 месяца |
67,6 ± 1,8 |
68,5 ± 2,8 |
69,3 ± 2,0 |
|
6 месяцев |
66,1 ± 1,5 |
65,1 ± 1,4 |
67,7 ± 1,6 |
|
Самки |
|||
|
До введения (фон) |
66,9 ± 1,4 |
63,3 ± 2,5 |
68,5 ± 2,2 |
|
2 месяца |
62,5 ± 2,2 |
66,6 ± 2,9 |
63,6 ± 2,1 |
|
4 месяца |
62,7 ± 1,9 |
63,8 ± 2,4 |
68,8 ± 2,3 |
|
6 месяцев |
65,7 ± 2,5 |
67,8 ± 1,2 |
67,0 ± 0,9 |
Для выявления возможного повреждающего действия субстанции «Литовит-М» на печень, исследовали активность аспартат – аланинаминотрансфераз, щелочной фосфатазы и общей лактатдегидрогеназы сыворотки крови.
На протяжении всего хронического эксперимента изменения активности этих ферментов в сыворотке крови животных всех подопытных групп не выходили за пределы физиологической нормы для данного вида лабораторных животных. Активность аминотрансфераз, лактатдегидрогеназы, а также щелочной фосфатазы у животных обоего пола, получавших внутрижелудочно субстанцию «Литовит-М» в дозах 1,5 и 3,0 г/кг в течение эксперимента, существенно не отличались от соответствующих показателей в контроле (таблицы 8 и 9).
Таблица 8. Показатели активности ферментов и уровня общего билирубина сыворотки крыс – самцов, получавших внутрижелудочно «Литовит-М» в течение 6 месяцев.
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Щелочная фосфатаза, Ед/л |
|||
|
До введения (фон) |
874,7 ± 33,2 |
738,8 ± 43,8 |
862,3 ± 21,9 |
|
2 месяца |
873,7 ± 37,6 |
824,9 ± 30,2 |
793,4 ± 39,7 |
|
4 месяца |
760,6 ± 39,6 |
793,6 ± 41,1 |
790,4 ± 43,7 |
|
6 месяцев |
782,3 ± 54,8 |
784,1 ± 43,7 |
796,5 ± 41,9 |
|
Аланинаминотрансфераза, Ед/л |
|||
|
До введения (фон) |
89,3 ± 5,4 |
79,0 ± 3,1 |
91,3 ± 3,9 |
|
2 месяца |
91,4 ± 4,4 |
72,9 ± 3,2 |
85,0 ± 4,6 |
|
4 месяца |
83,3 ± 4,3 |
79,7 ± 2,9 |
93,5 ± 5,2 |
|
6 месяцев |
89,4 ± 2,6 |
51,9± 2,2 |
87,7 ± 3,8 |
|
Аспартатаминотрансфераза, Ед/л |
|||
|
До введения (фон) |
139,4 ± 4,6 |
130,1 ± 3,8 |
128,2 ± 3,4 |
|
2 месяца |
134,1 ± 5,1 |
131,2 ± 3,8 |
139,3 ± 4,4 |
|
4 месяца |
145,8 ± 7,0 |
136,1 ± 3,9 |
140,0 ± 9,6 |
|
6 месяцев |
139,3 ± 3,2 |
128,5 ± 6,9 |
121,9 ± 6,6 |
|
Лактатдегидрогеназа, Ед/л |
|||
|
До введения (фон) |
1346,6 ± 106,5 |
1413,6 ± 114,4 |
1469,5 ± 117,8 |
|
2 месяца |
1337,8 ± 94,2 |
1339,5 ± 88,6 |
1313,7 ± 179,0 |
|
4 месяца |
1491,0 ± 99,8 |
1441,7 ± 178,8 |
1439,3 ± 118,0 |
|
6 месяцев |
1408,4 ± 79,7 |
1448,8 ± 119,7 |
1183,7 ± 96,3 |
|
Билирубин общий, мкмоль/л |
|||
|
До введения (фон) |
7,91± 0,32 |
8,20 ± 0,68 |
8,41 ± 0,56 |
|
2 месяца |
8,54 ± 0,47 |
8,76 ± 0,96 |
8,22 ± 0,58 |
|
4 месяца |
8,14 ± 0,412 |
8,23 ± 0,84 |
7,87 ± 0,32 |
|
6 месяцев |
8,40 ± 0,42 |
8,68 ± 0,82 |
8,25 ± 0,33 |
Таблица 9. Показатели активности ферментов и уровня общего билирубина сыворотки крыс – самок, получавших внутрижелудочно «Литовит-М» в течение 6 месяцев.
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Щелочная фосфатаза, Ед/л |
|||
|
До введения (фон) |
613,9 ± 35,7 |
627,2 ± 47,5 |
697,2 ± 26,1 |
|
2 месяца |
641,8 ± 28,8 |
664,6 ± 51,4 |
516,4 ± 20,4 |
|
4 месяца |
521,9 ± 25,9 |
614,3 ± 25,7 |
514,3 ± 36,9 |
|
6 месяцев |
599,6 ± 51,8 |
611,0 ± 40,3 |
564,9 ± 31,9 |
|
Аланинаминотрансфераза, Ед/л |
|||
|
До введения (фон) |
78,5 ± 3,0 |
73,6 ± 3,0 |
75,2 ± 3,2 |
|
2 месяца |
82,9 ± 5,1 |
83,1 ± 7,7 |
76,1 ± 3,7 |
|
4 месяца |
89,6 ± 3,4 |
86,0 ± 16,5 |
91,6 ± 7,4 |
|
6 месяцев |
72,9 ± 4,4 |
73,2 ± 5,3 |
74,4 ± 2,2 |
|
Аспартатаминотрансфераза, Ед/л |
|||
|
До введения (фон) |
119,2 ± 3,5 |
122,8 ± 5,0 |
119,0 ± 3,4 |
|
2 месяца |
120,3 ± 5,4 |
104,6 ± 8,5 |
109,6 ± 7,9 |
|
4 месяца |
120,3 ± 8,9 |
125,5 ± 6,3 |
135,5 ± 7,2 |
|
6 месяцев |
126,2 ± 5,2 |
128,3 ± 6,9 |
122,5 ± 5,8 |
|
Лактатдегидрогеназа, Ед/л |
|||
|
До введения (фон) |
1359,9 ± 99,3 |
1196,5 ± 106,2 |
1201,3 ± 98,5 |
|
2 месяца |
1447,5 ± 98,5 |
1233,4 ± 107,2 |
1302,3 ± 121,3 |
|
4 месяца |
1334,1 ± 79,6 |
1276,2 ± 104,2 |
1228,3 ± 117,6 |
|
6 месяцев |
1394,7 ± 61,8 |
1278,5 ± 93,3 |
1243,1 ± 103,6 |
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Билирубин общий, мкмоль/л |
|||
|
До введения (фон) |
8,05 ± 0,23 |
8,01 ± 0,28 |
8,59 ± 0,39 |
|
2 месяца |
8,21 ± 0,24 |
8,15 ± 0,23 |
8,23 ± 0,31 |
|
4 месяца |
8,35 ± 0,30 |
8,27 ± 0,26 |
8,79 ± 0,38 |
|
6 месяцев |
8,67 ± 0,39 |
7,98 ± 0,27 |
8,23 ± 0,26 |
Уровни содержания мочевины и креатина в сыворотки крови животных, подвергавшихся воздействию «Литовита – М» на протяжении всего эксперимента, не отличалась от соответствующих показателей в контроле (см. таблицу 10).
Таблица 10. Уровни мочевины и креатина в сыворотке крови крыс обоего пола, получавших внутрижелудочно «Литовит-М» в течение 6 месяцев.
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Самцы, мочевина, ммоль/л |
|||
|
До введения (фон) |
19,26 ± 0,62 |
18,67 ± 0,72 |
19,17 ± 0,35 |
|
2 месяца |
18,70 ± 0,53 |
18,54 ± 0,46 |
18,73 ± 0,44 |
|
4 месяца |
18,46 ± 0,59 |
18,41 ± 0,52 |
18,56 ± 0,52 |
|
6 месяцев |
18,24 ± 0,43 |
18,54 ± 0,67 |
17,86 ± 0,66 |
|
Самцы, креатин, ммоль/л |
|||
|
До введения (фон) |
106,9 ± 3,1 |
106,4 ± 2,8 |
101,1 ± 4,3 |
|
2 месяца |
105,0 ± 3,4 |
108,5 ± 3,5 |
110,3 ± 6,2 |
|
4 месяца |
111,8 ± 8,9 |
115,6 ± 8,4 |
105,3 ± 6,1 |
|
6 месяцев |
101,7 ± 7,5 |
107,6 ± 6,1 |
102,1 ± 6,4 |
|
Самки, мочевина, ммоль/л |
|||
|
До введения (фон) |
18,63 ± 0,67 |
18,25 ± 0,75 |
18,60 ± 0,73 |
|
2 месяца |
18,82 ± 0,42 |
18,66 ± 0,53 |
18,39 ± 0,45 |
|
4 месяца |
18,84 ± 0,37 |
18,82 ± 0,73 |
18,89 ± 0,46 |
|
6 месяцев |
18,38 ± 0,46 |
18,55 ± 0,33 |
19,24 ± 0,48 |
|
Самки, креатин, ммоль/л |
|||
|
До введения (фон) |
95,4 ± 6,5 |
97,6 ± 5,1 |
97,3 ± 6,3 |
|
2 месяца |
84,8 ± 8,4 |
85,8 ± 7,2 |
96,9 ± 7,1 |
|
4 месяца |
97,9 ± 9,2 |
98,6 ± 6,3 |
102,7 ± 9,5 |
|
6 месяцев |
95,9 ± 8,9 |
94,4 ± 7,9 |
103,6 ± 6,7 |
Для оценки влияния «Литовита-М» на углеводный обмен и функцию поджелудочной железы в условиях 6 – месячного хронического эксперимента определяли содержание глюкозы в сыворотке крови подопытных животных.
Как показали проведенные исследования, в течение всего эксперимента «Литовит-М» в испытанных дозах 1,5 и 3,0 г/кг (при взятии крови через 1 сутки после последнего введения препарата) не влиял на уровень глюкозы в сыворотке крови крыс; его параметры характеризовались стабильностью (7,3 – 9,9 ммоль/л у самок) и не выходили за границы допустимых физиологических колебаний для данного вида лабораторных животных (см. таблицу 11).
Таблица 11. Уровень глюкозы (ммоль/л) в сыворотке крови крыс при внутрижелудочном введении «Литовита-М».
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Самцы |
|||
|
До введения (фон) |
7,9 ± 0,3 |
8,0 ± 0,3 |
8,1 ± 0,3 |
|
2 месяца |
7,4 ± 0,5 |
8,1 ± 0,5 |
9,2 ± 0,7 |
|
4 месяца |
7,3 ± 0,4 |
8,5 ± 0,4 |
8,8 ± 0,5 |
|
6 месяцев |
8,6 ± 0,8 |
9,9 ± 0,6 |
9,0 ± 0,3 |
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Самки |
|||
|
До введения (фон) |
8,2 ± 0,3 |
8,5 ± 0,5 |
8,6 ± 0,5 |
|
2 месяца |
7,4 ± 0,4 |
7,2 ± 0,4 |
8,4 ± 0,3 |
|
4 месяца |
7,2 ± 0,5 |
8,0 ± 0,9 |
7,9 ± 0,3 |
|
6 месяцев |
8,7 ± 0,4 |
9,4 ± 0,5 |
9,8 ± 0,5 |
Для выявления возможного повреждающего действия «Литовита-М» в условиях 6- месячного хронического эксперимента на липидный обмен было исследовано содержание в сыворотке крови животных общего холестерина и триглицеридов. Как показали проведенные исследования, назначение «Литовита-М» внутрижелудочно крысам в течение всего эксперимента в дозах 1,5 и 3,0 г/кг не влияло на указанные показатели липидного обмена (см. таблицу 12).
Таблица 12. Содержание холестерина и триглицеридов в сыворотке крови крыс, получавших внутрижелудочно в течение 6 месяцев «Литовита-М».
|
Периоды наблюдения |
Группы животных |
||
|
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
3. «Литовит-М» 3,0 г/кг |
|
|
Самцы, холестерин, ммоль/л |
|||
|
До введения (фон) |
1,28 ± 0,09 |
1,18 ± 0,03 |
1,31 ± 0,07 |
|
2 месяца |
1,05 ± 0,08 |
1,12 ± 0,07 |
1,28 ± 0,10 |
|
4 месяца |
1,13 ± 0,04 |
1,21 ± 0,08 |
1,36 ± 0,08 |
|
6 месяцев |
1,30 ± 0,10 |
1,20 ± 0,09 |
1,32 ± 0,12 |
|
Самцы, триглицериды, ммоль/л |
|||
|
До введения (фон) |
0,96 ± 0,09 |
1,06 ± 0,08 |
0,94 ± 0,07 |
|
2 месяца |
1,02 ± 0,06 |
1,02 ± 0,12 |
0,93 ± 0,08 |
|
4 месяца |
0,98 ± 0,08 |
1,03 ± 0,11 |
0,91 ± 0,09 |
|
6 месяцев |
1,05 ± 0,09 |
1,12 ± 0,09 |
0,96 ± 0,11 |
|
Самки, холестерин, ммоль/л |
|||
|
До введения (фон) |
1,20 ± 0,04 |
1,24 ± 0,05 |
1,21 ± 0,05 |
|
2 месяца |
1,27 ± 0,05 |
1,26 ± 0,07 |
1,22 ± 0,04 |
|
4 месяца |
1,26 ± 0,09 |
1,27 ± 0,08 |
1,26 ± 0,03 |
|
6 месяцев |
1,31 ± 0,09 |
1,23 ± 0,09 |
1,21 ± 0,16 |
|
Самки, триглицериды, ммоль/л |
|||
|
До введения (фон) |
0,85 ± 0,07 |
0,96 ± 0,04 |
0,97 ± 0,06 |
|
2 месяца |
0,91 ± 0,08 |
1,22 ± 0,09 |
1,08 ± 0,08 |
|
4 месяца |
1,02 ± 0,08 |
1,29 ± 0,15 |
1,11 ± 0,12 |
|
6 месяцев |
1,18 ± 0,15 |
1,24 ± 0,17 |
1,24 ± 0,19 |
Проведенные исследования показали, что внутрижелудочное введение субстанции «Литовита-М» крысам Wistar обоего пола ежедневно в течение 6 месяцев в дозах 1,5 и 3,0 г/кг (20- и 40- кратные терапевтические дозы, рекомендованные для человека) не влияет на общее состояние и поведение животных, не изменяет функционального состояния важнейших органов и систем организма подопытных животных.
Патоморфологические исследования крыс, получавших «Литовит-М» в течение 6 месяцев.
Результаты макроскопического исследования:
- Шерсть: лоснящаяся во всех трех группах.
- Слизистые оболочки: контроль – выражен синюшный оттенок влажных слизистых оболочек. Опытные группы – слизистые влажные, блестящие.
- Кожные покровы и скелет: во всех трех группах не повреждены. Обычное расположение внутренних органов.
- Серозные оболочки: во всех трех группах без изменений (гладкие, влажные, серые, блестящие в виде пленки).
- Полости сердца, вены и венозные синусы во всех трех группах наполненны темной жидкой кровью.
- Головной мозг во всх трех группах: с обычными извилинами и бороздами. Оболочки мозга тонкие, гладкие, блестящие, полнокровные. Четкие границы серого и белого вещества головного и спинного мозга.Ткань мозга блестит на разрезах, очаговые изменения в ней отсутствуют. Желудочки мозга щелевидные, с полнокровными, дряблыми, сосудистыми венозными сплетениями и небольшим количеством прозрачной жидкости. Гипофиз округлый, инкапсулированный, дряблый, бледно – серый.
- Щитовидная железа: контроль - обе доли расположены симметрично, полнокровные, красноватые, мелкозернистые. Опытные группы: обе доли расположены симметрично, на разрезе зернистая, полнокровная. В капсуле видны 4 плотные белесоватые паращитовидные железки.
- Слюнные железы во всех трех группах инкапсулированы, плотные, серые, дольчатые.
- Вилочковая железа во всех трех группах синюшного цвета, дольчатая со сливными экхимозами под капсулой.
- В трахее и главных бронхах во всех трех группах следы слизи, слизистая оболочка их гладкая, блестящая, синюшная.
- Легкие во всех трех группах воздушные, пушистые, покрыты тонкой плеврой сероватого цвета, с единичными экхимозами под плеврой, неравномерное кровенаполнение передненижних долей.
- Сердце во всех трех группах плотное, с полупрозрачными гладкими створками клапанов и тонким, гладким, блестящим эндокардом, серо – красным, сочным, без очаговых изменений, плотным миокардом, умеренным количеством экхимозов под эпикардом, обычным рисунком расположения коронарных артерий и вен. Интима ствола легочной артерии и аорты гладкая, блестящая.
- Пищевод во всех трех группах с гладкой, блестящей полнокровной слизистой оболочкой. Брюшина тонкая, гладкая, блестящая. Лимфатические узлы брюшины инкапсулированы, не увеличены, плотные, на разрезе сероватые.
- Селезенка во всех трех группах с гладкой капсулой, плотная, пульпа красная, без соскоба, фолликулы не различимы.
- Печень во всех трех группах дольчатая, плотная, с гладкой капсулой, красно – коричневая, на разрезе полнокровная. Желчный пузырь заполнен густой желчью темно – оливкового цвета, слизистая оболочка его бархатистая, тонкая.
- Поджелудочная железа: контроль - в капсуле, плотная, дольчатая, серовато – синюшного цвета. В опытных группах в прозрачной капсуле, плотная, серовато – синюшного цвета на разрезе, без изменений.
- Надпочечники во всех трех группах овальной формы, плотные, с четким делением паренхимы на мозговой и корковой слои.
- Почки плотные во всех трех группах с гладкой поверхностью, легко снимающейся капсулой, четкой границей красноватой коры и бледно – серого мозгового слоя, слизистая оболочка лоханок и мочевого пузыря тонкая, гладкая, блестящая.
- Желудок формы рога во всех трех группах с тонкими стенками, рельефными, серыми складками слизистой оболочки, без каких – либо очаговых изменений.
- Кишечник всех трех групп содержит окрашенный желчью химус и кашицеобразные, коричневые каловые массы. Стенки его тонкие, слизистая оболочка тонкого кишечника бархатистая, серовато – розовая, толстого – серая, складчатая, очаговых изменений не обнаружено.
- Органы репродукции во всех трех группах имеют обычный рисунок строения.
По данным макроскопического исследования контроль составили здоровые животные, макроскопическое исследование групп животных, принимавших «Литовит-М» в дозировке 1,5 г/кг и 3,0 г/кг не выявило токсического и токсико – аллергического действия последнего.
Результаты микроскопического исследования:
1 группа – контроль (самцы и самки).
Светооптический анализ структур изученных органов у всех животных данной группы демонстрирует однотипные результаты.
В головном мозге нейроны больших полушарий имеют пирамидальную или полигональную форму, окружены бесструктурными глиальными клетками с четким ядром. В подкорковом слое пучки нейроволокон различной природы, скопления нейронов в виде отдельных ядер.
В гипофизе петли полнокровных капилляров в передней доле окружены секреторными клетками с преимущественно оксифильной цитоплазмой. Фолликулы в средней доле округлой формы, многочисленны, заполнены бесструктурным коллоидом. В задней доле нейропиль, единичные фолликулы.
Слюнные железы состоят из интенсивно базофильных железистых клеток, слюновыводящие протоки свободные, выстланы плазматическим эпителием, строма развита слабо.
В щитовидной железе строма развита слабо, фолликулы имеют овальную форму, заполнены бесструктурным коллоидом, сосуды полнокровны.
Тимус имеет дольковое строение, лимфоциты расположены преимущественно в корковом отделе, в мозговом – лимфоциты менее многочисленны.
Легкие с хорошо расправленными альвеолами, просветы их свободные, стенки альвеол тонкие, сосуды полнокровные. В просветах крупных бронхов незначительное количество бесструктурного эскудата. Бронхиолы и бронхи выстланы кубическим и призматическим эпителием.
Сердце – эпикард и этнокард представлены тонкими листками соединительной ткани с включением фибробластов. Крупные субэпикардиальные и энтрамиокардиальные ветви коронарных артерий тонкостенные, выстланы упорядоченным эндотелием, с выраженной базальной мембраной, медией и адвентицией. Кардиомициты с тонкой сарколеммой, оксифильной саркоплазмой и периферически расположенными базофильными овальными ядрами.
В коре надпочечников мелкие железистые клетки расположены послойно. В мозговом – полигональные хромаффинные клетки, свободные синусы.
В почках почечные тельца округлой формы, субкапсулярная полость свободна, структура капиллярных путей сохранена. Эпителий проксимальных, дистальных канальцев и петель Генле с апикально ориентированными ядрами, лоханки выстланы переходным эпителием. Сосуды полнокровны, с сохранным эндотелием.
В печени строма развита слабо, печеночные дольки призматической и овальной формы, центральные вены свободные, гепатоциты с четкой структурой, синусоидные капилляры полнокровные. Портальные тракты имеют обычный рисунок строения.
В поджелудочной железе равномерно базофильные экстректорные железистые клетки ацинусов, эпителиальная выстилка выходящих протоков не повреждена. Островковый аппарат в тонкой капсуле, содержит светлые полиморфные клетки обычной структуры.
Слоистая оболочка желудка представлена трубчатыми железами, выстланными цилиндрическим эпителием, в которой различимы шеечные, париетальные и обкладочные клетки, подслизистый слой представлен рыхлой соединительной тканью с неповрежденными сосудами, мышечная оболочка с разнонаправленными пучками гладких миоцитов, серозная оболочка покрыта мезотелием.
Тонкая и толстая кишки имеют обычный рисунок строения.
Капсула и трабекулы селезенки не утолщены. Паренхима состоит их обширных синусов, содержащих эритроциты, лимфоциты и ретикулярные клетки, лимфоидные фолликулы обычных размеров.
В лимфатических узлах полиморфные фолликулы из мелких лимфоидных клеток, слабо развитая строма. Органы репродуктивной системы имеют обычный рисунок строения.
Микроскопические данные в совокупности с результатами макроскопического анализа свидетельствуют о том, что контрольную группу составили практически здоровые животные.
2 группа – «Литовит-М» 1,5 г/кг (самцы и самки)
В головном мозге нейроны больших полушарий имеют пирамидальную или полигональную форму, окружены бесструктурными глиальными клетками с четким ядром. Незначительный перицеллюлярный отек. Сосудистая сеть развита умеренно.
В передней и средних долях гипофиза многочисленные синусоидные капилляры окружены слабо ацидофильными и единичными базофильными клетками. В средней доле дополнительно обнаруживаются небольшие фолликулоподобные образования, окруженные слоем железистых клеток. В задней доле – нейропиль с капиллярами и множеством мелких пуицитов.
Щитовидная железа представлена крупными фолликулами, выстланными кубическим эпителием и заполненные бесструктурным коллоидом, строма развита слабо.
Железистые клетки слюнных желез со светлой цитоплазмой, структурным ядром выстилают свободно проходимые секреторные пути.
Тимус имеет четкое дольковое строение. В дольках различимо мозговое и корковое вещество. В коре – обширные скопления лимфоидных клеток. В мозговом веществе – ретикулоэпителий, немногочисленные клетки лимфоидного ряда. В субкапсулярном слое обнаруживаются немногочисленные участки пропитывания паренхимы органа клеточными элементами крови с незначительным отеком межуточного вещества.
В легких основное поле зрения занимают округлые, хорошо расправленные альвеолы с тонкими стенками и свободным просветом. Бронхиолы и бронхи выстланы кубическим и призматическим эпителием. Строма полнокровна.
Сердце – эпикард и этнокард представлены тонкими листками соединительной ткани с включением фибробластов. Крупные субэпикардиальные и энтрамиокардиальные ветви коронарных артерий тонкостенные, выстланы упорядоченным эндотелием, с выраженной базальной мембраной, медией и адвентицией. Миокард состоит из кардиомицитов с тонкой сарколеммой, оксифильной саркоплазмой и периферически расположенными базофильными овальными ядрами. Строма полнокровна.
Экскреторный отдел поджелудочной железы представлен базофильными железистыми клетками и ацидофильными клетками выводящих протоков. Строма развита слабо, просветы протоков свободные. Инкреторные клетки сгруппированы в виде отдельных островков слабо оксифильных клеток, ограниченных от окружающих тканей общей стромальной капсулой. Структура не нарушена.
В печени гепатоны состоят из радикально ориентированных гепатоцитов с сохранной структурой, синусоиды полнокровны. Портальные тракты содержат артерии вены и желчные протоки. Центральные вены свободны, стенки их тонкие.
Основную долю стенки желудка занимает слизистая оболочка, выстланная неповрежденным железистым эпителием, имеющая в своем составе собственные трубчатые железы. В подслизистой – рыхлая неоформленная соединительная ткань, многочисленные скопления железистых, лимфоидных клеток, густая смесь микроциркулярного русла. Пучки гладкомышечных клеток ориентированы послойно, покрыты снаружи мезотелием.
Стенка тонкого кишечника выстлана со стороны просвета каемчатым эпителием.
Селезенка состоит их обширных синусов, содержащих эритроциты, лимфоидные фолликулы обычных размеров. Капсула и трабекулы не утолщены.
В лимфатических узлах пролиферация ретикулоэндотелиальных элементов, полнокровны, краевые синусы расширены.
Органы репродуктивной системы имеют обычный рисунок строения.
3 группа – «Литовит-М» 3,0 г/кг (самцы и самки).
Результаты микроскопического исследования головного мозга, гипофиза, щитовидной железы, слюнных желез, тимуса, легких, сердца, поджелудочной железы, печени, желудка, тонкого кишечника, селезенки, лимфатических узлов, органов репродуктивной системы аналогичны результатам во 2 группе животных.
Данные макро- и микроскопических исследований свидетельствуют об отсутствии токсического и токсико – аллергического действия «Литовита-М» при шестимесячном введении в желудок крысам в дозах 1,5 и 3,0 г/кг.
ИССЛЕДОВАНИЕ ТОКСИЧНОСТИ БАД К ПИЩЕ «ЛИТОВИТ-М» В УСЛОВИЯХ ТРЕХМЕСЯЧНОГО ХРОНИЧЕСКОГО ЭКСПЕРИМЕНТА НА СОБАКАХ.
Условия проведения эксперимента и методы исследований
Исследования проведены на 8 беспородных собаках (самцы, первоначальная масса тела 16,0 – 18,0 кг), которые были разделены на 2 группы по 4 животных в каждой: 1 группа – контроль; 2 группа – «Литовит-М» в дозе 1,05 г/кг (15- кратная суточная рекомендуемая доза для человека).
«Литовит-М» в исследуемой дозе скармливали собакам с небольшим количеством мясного фарша в два приема ежедневно в течение трех месяцев.
На протяжении эксперимента отмечали общее состояние и поведение животных (динамика массы тела, аппетит, двигательная активность, состояние шерстного покрова), измеряли ректальную температуру. У всех собак до начала эксперимента, а также через 1 и 3 месяца введения препарата исследовали гематологические показатели (количество эритроцитов, лейкоцитов, тромбоцитов, уровень гемоглобина, лейкоцитарная формула), ряд биохимических показателей и активность ферментов сыворотки крови (общий белок, холестерин, мочевина, креатинин, триглицериды, глюкоза, активность аспартат- и аланинаминотрансферазы, щелочной фосфатазы и лактатдегидрогеназы).
Для исследования указанных показателей у собак брали кровь из подкожной вены голени в количестве 2,5 – 3,0 мл.
Оценку функционального состояния сердечно – сосудистой системы у собак (ЭКГ – исследования во II стандартном отведении) проводили до начала исследования, через 1 и 3 месяца назначения «Литовита-М» с помощью прибора «Биограф» (США).
При исследовании гематологических и биохимических показателей, а также при определении активности ферментов сыворотки крови использовали методы, описанные ранее при экспериментах на крысах.
Статистическую обработку всех полученных данных проводили с помощью компьютера IBM PC/AT 486 «Genitek» (Тайвань).
Оценка влияния «Литовита-М» на организм собак в условиях 3-месячного хронического эксперимента.
Как показали проведенные исследования, внутрижелудочное введение «Литовита-М» в дозе 1,05 г/кг на протяжении 3 месяцев не влияло на общее состояние и поведение животных. Во все периоды наблюдения (1-й, 2-й и 3-й месяцы эксперимента) не зарегистрировано различий динамики массы тела контрольной и подопытной групп (см. таблицу 10). Не установлено статистически достоверных различий показателей ректальной температуры у собак, подвергавшихся воздействию «Литовита-М» и контрольных (см. таблицу 13).
Таблица 13. Динамика массы тела и ректальной температуры у собак при 3- месячном внутрижелудочном введении «Литовита-М» в дозе 1,05 г/кг.
|
Периоды наблюдения |
1. Контроль |
2. «Литовит-М» 1,5 г/кг |
|
Масса тела, % от исходной |
||
|
1 месяц |
103,2 ± 2,7 |
108,8 ± 2,4 |
|
2 месяца |
103,7 ± 4,3 |
106,1 ± 3,8 |
|
3 месяца |
106,4 ± 4,5 |
109,6 ± 4,9 |
|
Ректальная температура, oС |
||
|
До введения (фон) |
38,6 ± 0,3 |
38,7 ± 0,2 |
|
1 месяц |
38,5 ± 0,1 |
38,6 ± 0,2 |
|
2 месяца |
38,6 ± 0,2 |
38,8 ± 0,2 |
|
3 месяца |
38,7 ± 0,1 |
38,5 ± 0,3 |
Электрокардиографические исследования, проведенные до начала исследования, через 1 и 3 месяца внутрижелудочного введения «Литовита-М» собакам в испытанной дозе 1,05 г/кг, не выявили повышения частоты сердечных сокращений и изменений параметров ЭКГ под влиянием изучаемого препарата. Все показатели ЭКГ не выходили за пределы допустимых колебаний, характерных для данного вида лабораторных животных (см. таблицу 14).
Таблица 14. Параметры ЭКГ собак, получавших внутрижелудочно в течение 3-х месяцев «Литовит-М» в дозе 1,05 г/кг.
|
Параметры ЭКГ |
До введения |
1 месяц |
3 месяц |
|||
|
1. Контроль |
2. «Литовит -М» 1,5 г/кг |
1. Контроль |
2. «Литовит -М» 1,5 г/кг |
1. Контроль |
2. «Литовит -М» 1,5 г/кг |
|
|
R-R, мсек |
503 ± 36 |
492 ± 27 |
506 ± 29 |
489 ± 31 |
486 ± 32 |
497 ± 23 |
|
P-Q, мсек |
96 ± 14 |
89 ± 17 |
98 ± 19 |
96 ± 16 |
101 ± 21 |
94 ± 19 |
|
Q-T, мсек |
156 ± 26 |
136 ± 28 |
142 ± 26 |
147,6 ± 23 |
149 ± 25 |
139 ± 22 |
|
QRS, мсек |
35 ± 3 |
36 ± 3 |
34 ± 3 |
33 ± 4 |
35 ± 4 |
38 ± 4 |
|
ST, мсек |
0,4 ± 0,1 |
0,4 ± 0,1 |
0,4 ± 0,1 |
0,3 ± 0,1 |
0,3 ± 0,1 |
0,3 ± 0,1 |
|
TP, мсек |
196 ± 20 |
189 ± 21 |
182 ± 24 |
178,6 ± 27 |
186 ± 19 |
191 ± 22 |
|
P, мв |
0,29 ± 0,03 |
0,31 ± 0,03 |
0,32 ± 0,04 |
0,34 ±0,04 |
0,29 ± 0,02 |
0,34 ± 0,03 |
|
R, мв |
1,34 ± 0,23 |
1,29 ± 0,36 |
1,31 ± 0,25 |
1,30 ± 0,28 |
1,41 ± 0,26 |
1,46 ± 0,29 |
|
Т, мв |
0,22 ± 0,04 |
0,24 ± 0,03 |
0,26 ± 0,05 |
0,19 ± 0,04 |
0,23 ± 0,04 |
0,19 ± 0,05 |
|
ЧСС в мин |
123 ± 16 |
131 ± 19 |
133 ± 21 |
119 ± 23 |
111 ± 27 |
121 ± 19 |
При исследовании морфологического состава периферической крови собак, получавших «Литовит-М» в дозе 1,05 г/кг, не отмечено достоверных различий гематологических показателей по сравнению с контролем (см. таблицу 15).
Таблица 15. Гематологические показатели собак при 3- месячном внутрижелудочном введении «Литовита-М».
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
Эритроциты, 1012/л |
||
|
До введения (фон) |
6,7 ± 0,3 |
6,4 ± 0,2 |
|
1 месяц |
6,5 ± 0,4 |
6,3 ± 0,3 |
|
3 месяца |
6,2 ± 0,3 |
6,8 ± 0,3 |
|
Лейкоциты, 109/л |
||
|
До введения (фон) |
8,7 ± 0,6 |
8,3 ± 0,2 |
|
1 месяц |
8,9 ± 0,7 |
9,1 ± 0,4 |
|
3 месяца |
8,3 ± 0,4 |
8,5 ± 0,6 |
|
Тромбоциты, 109/л |
||
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
До введения (фон) |
366 ± 23 |
326 ± 19 |
|
1 месяц |
370 ± 26 |
339 ± 28 |
|
3 месяца |
341 ± 22 |
369 ± 31 |
|
Гемоглобин, г/л |
||
|
До введения (фон) |
102 ± 3 |
108 ± 5 |
|
1 месяц |
104 ± 5 |
105 ± 4 |
|
3 месяца |
99 ± 5 |
103 ± 4 |
Исследование лейкоцитарной формулы крови собак, проведено через 1 и 3 месяца назначения «Литовита-М» в испытанной дозе 1,05 г/кг, не выявило достоверных различий по сравнению с контролем (см. таблицу 16).
Таблица 16. Лейкоцитарная формула крови собак (%) при 3- месячном введении «Литовит-М» в дозе 1,05 г/кг
|
Группы животных |
Базофилы |
Эозинофилы |
Нейтрофилы |
Лимфоциты |
Моноциты |
|
|
Палочко ядерные |
Сегменто ядерные |
|||||
|
1 месяц |
||||||
|
Контроль |
0,6 ± 0,2 |
5,7 ± 0,6 |
4,5 ± 0,6 |
63,7 ± 3,1 |
21,8 ± 0,6 |
3,7 ± 0,4 |
|
«Литовит-М» в дозе 1,05 г/кг |
0,4 ± 0,2 |
6,1 ± 0,7 |
3,8 ± 0,7 |
62,5 ± 3,2 |
24,0 ± 0,3 |
3,2 ± 0,5 |
|
3 месяца |
||||||
|
Контроль |
0,7 ± 0,2 |
5,2 ± 0,9 |
3,5 ± 0,6 |
62,7 ± 2,1 |
24,1 ± 0,7 |
3,8 ± 0,4 |
|
«Литовит-М» в дозе 1,05 г/кг |
0,6 ± 0,3 |
5,1 ± 1,1 |
5,5 ± 1,1 |
61,3 ± 2,5 |
23,8 ± 0,5 |
3,7 ± 0,5 |
«Литовит-М» в дозе 1,05 г/кг на протяжении 3- месячного хронического эксперимента не влиял на уровень содержания общего белка сыворотки крови подопытных животных, что свидетельствует об отсутствии повреждающего действия препарата на белковообразующую функцию печени (см. таблицу 17).
Таблица 17. Содержание общего белка (г/л) в сыворотке крови собак при 3- месячном введении «Литовит-М».
|
Периоды наблюдения |
1. Контроль |
2. «Литовит-М» 1,05 г/кг |
|
До введения (фон) |
61,5 ± 3,7 |
58,5 ± 2,9 |
|
1 месяц |
60,9 ± 2,1 |
61,4 ± 2,2 |
|
3 месяца |
61,7 ± 2,4 |
63,8 ± 2,6 |
Для выявления возможного повреждающего действия «Литовита-М» в условиях хронического эксперимента на функцию печени собак исследовали активность щелочной фосфатазы, лактатдегидрогеназы, аспартат- и аланинаминотрансфераз в сыворотке крови животных.
Проведенные исследования показали, что «Литовит-М» в испытанной дозе 1,05 г/кг на протяжении 3- месячного эксперимента не влиял на активность указанных «печеночных» ферментов сыворотки крови (см. таблицу 18).
Таблица 18. Показатели активности ферментов сыворотки крови собак при 3-х месячном внутрижелудочном введении «Литовит-М».
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
Щелочная фосфатаза, Ед/л |
||
|
До введения (фон) |
84,3 ± 6,7 |
77,5 ± 7,1 |
|
1 месяц |
88,1 ± 5,9 |
81,2 ± 7,3 |
|
3 месяца |
91,4 ± 7,6 |
86,4 ± 6,5 |
|
Аланинаминотрансфераза, Ед/л |
||
|
До введения (фон) |
38,6 ± 6,8 |
39,1 ± 6,3 |
|
1 месяц |
34,5 ± 6,2 |
35,3 ± 6,1 |
|
3 месяца |
41,7 ± 5,4 |
42,4 ± 7,2 |
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
Аспартатаминотрансфераза, Ед/л |
||
|
До введения (фон) |
19,6 ± 6,4 |
22,5 ± 4,7 |
|
1 месяц |
26,7 ± 5,3 |
23,4 ± 6,4 |
|
3 месяца |
24,9 ± 5,1 |
22,4 ± 4,3 |
|
Лактатдегидрогеназа, Ед/л |
||
|
До введения (фон) |
176,3 ± 18,1 |
171,7 ± 14,5 |
|
1 месяц |
181,3 ± 21,6 |
184,6 ± 20,3 |
|
3 месяца |
162,7 ± 19,3 |
169,5 ± 15,8 |
На протяжении хронического эксперимента в сыворотке крови собак, получавших «Литовит-М» в дозе 1,05 г/кг, не отмечалось изменений уровня мочевины и креатина, что позволяет сделать вывод об отсутствии повреждающего действия «Литовита-М» на экскреторную функцию почек подопытных животных (см. таблицу 19).
Таблица 19. Уровень мочевины и креатина в сыворотке крови собак при 3-х месячном внутрижелудочном введении «Литовит-М».
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
Мочевина, ммоль/л |
||
|
До введения (фон) |
5,2 ± 0,7 |
5,7 ± 0,6 |
|
1 месяц |
5,5 ± 0,4 |
4,9 ± 0,5 |
|
3 месяца |
6,0 ± 0,8 |
5,2 ± 0,3 |
|
Креатин, ммоль/л |
||
|
До введения (фон) |
38,6 ± 6,8 |
39,1 ± 6,3 |
|
1 месяц |
34,5 ± 6,2 |
35,3 ± 6,1 |
|
3 месяца |
41,7 ± 5,4 |
42,4 ± 7,2 |
При оценке влияния длительного внутрижелудочного введения собакам «Литовита-М» в дозе 1,05 г/кг на углеводный обмен и функции поджелудочной железы исследовали уровень глюкозы в сыворотке крови подопытных животных.
При длительном введении изучаемого препарата («Литовита-М») не установлено влияние препарата на уровень глюкозы в сыворотке кроки подопытных животных (см. таблицу 20).
Таблица 20. Уровень глюкозы (ммоль/л) в сыворотке крови собак при 3-х месячном внутрижелудочном введении «Литовит-М».
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
До введения (фон) |
5,7 ± 0,3 |
5,5 ± 0,2 |
|
1 месяц |
5,3 ± 0,4 |
5,2 ± 0,3 |
|
3 месяца |
5,5 ± 0,2 |
5,1 ± 0,2 |
Для исследования возможного повреждающего действия «Литовита-М» на липидный обмен при длительном введении препарата в желудок исследовали уровень общего холестерина и триглицеридов в крови собак.
Результаты проведенных исследований показали, что длительное введение в организм животных изучаемого препарата не влияет на указанные показатели липидного обмена (см. таблицу 21).
Таблица 21. Уровень холестерина и триглицеридов в сыворотке крови собак при 3-х месячном внутрижелудочном введении «Литовит-М».
|
Периоды наблюдения |
Группы животных |
|
|
Контроль |
Литовит-М, 1,05 г/кг |
|
|
Общий холестерин, ммоль/л |
||
|
До введения (фон) |
3,17 ± 0,12 |
3,31 ± 0,15 |
|
1 месяц |
3,24 ± 0,15 |
3,19 ± 0,09 |
|
3 месяца |
3,09 ± 0,11 |
3,22 ± 0,12 |
|
Триглицериды, ммоль/л |
||
|
До введения (фон) |
0,69 ± 0,09 |
0,72 ± 0,09 |
|
1 месяц |
0,71 ± 0,06 |
0,63 ± 0,06 |
|
3 месяца |
0,74 ± 0,07 |
0,76 ± 0,05 |
В результате проведенных исследований установлено, что внутрижелудочное введение собакам БАД к пище «Литовит-М» ежедневно в течение 3-х месяцев в дозе 1,05 г/кг (15- кратная рекомендуемая доза для человека) не влияет на общее состояние и поведение животных, не изменяет функционального состояния важнейших органов и систем собак.
ИЗУЧЕНИЕ МУТАГЕННЫХ СВОЙСТВ БАД К ПИЩЕ «ЛИТОВИТ-М»
Под влиянием химических соединений в генетическом аппарате клетки возникают потенциальные изменения, которые затем, в результате сложных событий внутри клетки либо приводят к устойчивой мутации, либо репарируются. Уровни активности систем репарации различны в различных тканях и у разных видов животных. Существуют химические соединения, подавляющие систему репарации повреждений ДНК, что может привести к увеличению мутагенной активности слабых мутагенов. Т.о., при определении мутагенности химических соединений необходимо использовать не один, а набор методов и тест – систем.
В соответствии с рекомендациями Фармакологического государственного комитета Министерства здравоохранения РФ в систему исследования биологически активных препаратов для выявления среди них потенциальных мутагенов включен набор методов, с помощью которых можно зарегистрировать мутации различных типов – хромосомные аберрации, генные мутации, а также суммарно все типы повреждений в половых клетках млекопитающих. При изучении мутагенности субстанции «Литовита-М» в лаборатории лекарственной токсикологии РКНПК МЗ РФ были проведены следующие исследования:
- Учет генных мутаций на микроорганизмах в тесте Эймса.
- Учет хромосомных аберраций в клетках костного мозга млекопитающих.
- Учет доминантных летальных мутаций в зародышевых клетках мышей.
Изучение мутагенных свойств субстанции «Литовит-М» на микроорганизмах в тесте Эймса
Суть метода: сконструированные тестерные штаммы Salmonella typhimurium культивируют на специальной среде, на которой могут развиваться лишь те микроорганизмы, у которых произошла обратная мутация к дикому штамму. Частота спонтанных обратных мутаций известна для каждого штамма и определяется в каждом опыте как контроль. Если в среду ввести химический мутаген, то частота обратных мутаций значительно увеличивается, что регистрируется по числу колоний микроорганизмов, выросших на селективной среде.
Оценка мутагенной активности субстанции «Литовита-М» проведена методом учета способности соединения индуцировать генные мутации у индикаторных микроорганизмов в системе метаболической активации in vitro. Использован чашечный метод учета мутаций, предложенный Ames et al (1972; 1984) в модификации, рекомендуемой Методическими указаниями Фармакологического государственного комитета МЗ РФ по тестированию препаратов на стадии их доклинического токсикологического изучения (1999).
В качестве индикаторных микроорганизмов использовали ауксотрофные по гистину штаммы Salmonella typhimurium ТА98, ТА100, ТА1537. О наличии мутагенного действия препарата судили по индукции обратных мутаций от ауксотрофности по гистину к прототрофности. Штамм ТА98 несет мутацию his D3052, фреймшифт мутацию типа – 1.
Реверсия к дикому типу происходит за счет делеции в 2 Ц-Г
Г-Ц
в последовательности: Ц-Г-Ц-Г-Ц-Г-Ц-Г
Г-Ц-Г-Ц-Г-Ц-Г-Ц, находящейся недалеко от сайта мутации.
Мутация his D3052 использована в тесторном штамме для доказательства способности изучаемого вещества индуцировать мутации типа сдвига рамки считывания. В качестве позитивного контроля на мутацию his D3052 использовали 4- нитрохинолин-1-оксид (4 NQO).
Мутация his С3076 – это мутация сдвига рамки считывания штамма ТА1537. Последовательность ДНК мутанта his С3076 не определена, однако известно, что она содержит один добавленный цитозин к ряду из трех цитозинов и супрессируется супрессором suf B. Как позитивный контроль на мутацию his С3076 использовали 9-аминоакридин.
Штамм ТА100 несет мутацию his G46, миссенс – мутацию, ревертирующую под действием многих мутагенов, индуцирующих замены пар оснований. В качестве положительного контроля на эту мутацию применяли азид натрия. Перед работой штаммы были проверены на ауксотрофность к гистидину, на наличие у штаммов ТА98 и ТА100 плазмиды рКМ 101 и наличие мутации rfa.
Метод позволяет изучить как прямое действие исследуемого вещества на тесторные штаммы, так и действие его метаболитов, образующихся под влиянием микросомальной фракции индуцированной печени крысы.
Для получения исходного раствора 100 мг «Литовита-М» взмучивали в дистиллированной воде в концентрации 10 мг/мл, стерилизовали автоклавированием, получали гомогенную суспензию. Дальнейшее разведение выполняли в стериальной дистиллированной воде. Исследовали концентрации «Литовита-М» от 0,1 до 1000 мкг/ чашку.
Селективный полуобогащенный агар в пробирках в объеме 2 мл плавили на водяной бане при температуре 1000С, охлаждали в термостатируемой водяной бане до температуры 44 – 450С. В пробирки с агаром вносили 100 мкл раствора препарата, 100 мкл суспензии ночной культуры бактерий, 100 мкл фракции S9 печени крысы и кофакторы. Микросомальную фракцию печени крысы, индуцированной Aroclor, получали в виде лиофилизата у фирмы Labsystems, Финляндия. Проводили опыт как с полной микросомальной активирующей смесью, ПАМС, так и с неполной активирующей микросомальной смесью НАМС.
Указанные смеси вносили в пробирки после извлечения их из термостатирующей бани и тут же наносили полужидкий агар на слой минимального агара на чашках Петри. После полного застывания агара чашки переносили в термостат при 370С. На каждую дозу препарата делали 3 повторности с ПАМС и 3 повторности с НАМС. Через 48 часов инкубации при 370С производили учет прототрофных ревертантов.
Как видно из данных, представленных в таблице 19, бактериальные штаммы увеличивали число ревертантов под действием веществ, взятых в качестве положительных контролей, т.е. экспериментальные данные объективны. В тоже время «Литовит-М» не вызывал достоверного увеличения числа ревертантов.
По результатам исследования выявлено, что БАД к пище «Литовит-М» в концентрациях 0,1 – 1000,0 мкг/чашку не вызывает стимуляции роста ревертантов (см. таблицу 22).
Таблица 22. Результаты изучения мутагенного действия «Литовит-М» человека на индикаторные штаммы в тесте Эймса.
|
Препарат, доза, мкг |
Среднее геометрическое число ревертантов на чашку |
|||||
|
ТА 98 |
ТА 1537 |
ТА 100 |
||||
|
НАМС |
ПАМС |
НАМС |
ПАМС |
НАМС |
ПАМС |
|
|
«Литовит-М» |
||||||
|
0,1 |
63,6 |
58,0 |
7,0 |
8,7 |
68,6 |
64,6 |
|
1,0 |
58,0 |
82,6 |
6,0 |
9,6 |
51,0 |
59,0 |
|
10,0 |
71,0 |
71,0 |
8,0 |
5,6 |
83,6 |
61,6 |
|
100,0 |
58,6 |
45,8 |
6,0 |
6,0 |
70,9 |
71,6 |
|
1000,0 |
38,0 |
58,0 |
5,0 |
5,0 |
35,9 |
67,9 |
|
Контроль Н 2 О |
73,0 |
74,0 |
5,0 |
6,6 |
71,6 |
62,0 |
|
2-амино- антрацен, 10 мкг |
417,0 |
510,0 |
355,0 |
|||
|
4 NQO |
596,0 |
2926 |
||||
|
Азид натрия 1,5 мкг |
||||||
|
9-амино-акридин 10 мкг |
10000,0 |
|||||
Из представленных данных в отчете можно сделать вывод о том, что БАД к пище «Литовит-М» в концентрациях 0,1 – 1000,0 мкг/чашку не обладает мутагенным действием в тесте Эймса.
ИССЛЕДОВАНИЕ ЦИТОГЕНЕТИЧЕСКОЙ АКТИВНОСТИ «ЛИТОВИТА-М» МЕТОДОМ УЧЕТА ХРОМОСОМНЫХ АБЕРРАЦИЙ В КЛЕТКАХ КОСТНОГО МОЗГА МЫШЕЙ.
Сущность данного метода заключается в оценке влияния введенного в организм животного испытуемого вещества на такой чувствительной к воздействиям химических веществ и физических факторов, как генетический аппарат клеток костного мозга.
Эксперименты проведены на мышах гибридах FI (CBA*C57Bl 6 ) весом 18 – 20 г.
Растворы «Литовита-М» приготавливали на 1% крахмальном геле. «Литовит-М» вводили внутрижелудочно, однократно в дозе 70 мг/кг и 7 мг/кг, что составляло 1 и 100 рекомендуемых суточных доз для человека. Контрольной группе животных вводили внутрижелудочно 1% крахмальный гель. Животных забивали через 24 часа.
Параллельно проводили подострый эксперимент при введении препарата внутрижелудочно в дозе 70 мг/кг (1 кратная рекомендуемая доза для человека) ежедневно, на протяжении 5 дней 2 группам животных – самцам и самкам. В этом случае животных забивали через 24 часа после последнего введения препарата.
За 1 час до забоя мышам внутрибрюшинно вводили колхицин (фирмы «Serva») в дозе 4,8 мкг/г массы тела животного. Методика приготовления хромосомных препаратов из клеток костного мозга использована нами с некоторыми модификациями. Суспензию клеток костного мозга, полученную из бедренных костей, ресуспендировали в физиологическом растворе Хенкса, центрифугировали 7 минут при 1000 об/мин, затем недостаточную жидкость удаляли, осадок ресуспендировали в теплом (370С) гипотоническом растворе 0,075 М KCl и инкубировали в нем 50 минут, вновь ресуспендировали и центрифугировали, удаляя надосадочную жидкость. К осадку осторожно добавляли холодный фиксатор Карнуа (смесь абсолютного метилового спирта и ледяной уксусной кислоты в соотношении 3:1). Суспензию помещали на 30 минут в холодильник при –40С, после чего ресуспендировали, центрифугировали и надосадочную жидкость удаляли. Клетки ресуспендировали и трехкратно отмывали новыми порциями фиксатора Карнуа. После последнего отмыва весь надосадок удаляли и в 0,2 – 0,5 мл осадка (в зависимости от объема клеточной суспензии) добавляли свежий фиксатор, после чего суспензию наносили на холодные предметные стекла и высушивали над пламенем горелки. Препараты окрашивали азур – эозином. Метафазы анализировали на наличие в них хромосомных аберраций по рекомендациям ВОЗ.
Статистическую обработку полученных данных проводили с помощью сравнения распределений по t критерию Стьюдента.
Таблица 23. Учет структурных нарушений хромосом в клетках костного мозга мышей при действии «Литовита-М»
|
Вариант опыта |
Экспо-зиция |
Число метафаз |
Аберрации |
Доля клеток с аберрация ми |
||||
|
Одино- чные |
Парные |
Обмены |
Множест. |
Пробелы |
||||
|
«Литовит-М» однократно 70 мг/кг |
24 |
500 |
3 |
- |
- |
- |
- |
0,6 ± 0,2 |
|
«Литовит-М» однократно 3,5 мг/кг |
24 |
500 |
4 |
- |
- |
- |
- |
0,8 ± 0,3 |
|
«Литовит-М» 5-кратно 70 мг/кг самцы |
24 |
500 |
2 |
- |
- |
- |
- |
0,4 ± 0,2 |
|
«Литовит-М» 5-кратно 70 мг/кг самки |
24 |
500 |
2 |
- |
1 |
- |
- |
0,6 ± 0,2 |
|
Контроль |
24 |
500 |
3 |
- |
- |
- |
- |
0,6 ± 0,3 |
Из приведенных в отчете данных (таблица 23) видно, что статистически достоверных различий в уровне хромосомных аберраций в клетках костного мозга мышей, подвергавшихся воздействию изучаемого препарата в испытанных дозах по сравнению с контролем, не установлено. По примененному тесту учета хромосомных аберраций в клетках костного мозга млекопитающих «Литовит-М» не обладает мутагенной активностью.
ИЗУЧЕНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА ИНДУКЦИЮ ДОМИНАНТНЫХ ЛЕТАЛЬНЫХ МУТАЦИЙ В ЗАРОДЫШЕВЫХ КЛЕТКАХ МЫШЕЙ.
Сущность метода доминантных летальных мутаций 3 заключается в том, что под воздействием химических веществ могут произойти генетические изменения в гамете, которые убивают зиготу, развивающуюся из этой гаметы.
Испытуемые химические вещества вводят самцам. Если вещество обладает мутагенным действием, то под его влиянием в сперматозоидах самца возникают доминантные летальные мутации. Самцов скрещивают с интактными самками, которых забивают в определенный период беременности и производят подсчет зародышей, погибших на ранней стадии и получивших обратное развитие. Самок периодически заменяют, что позволяет судить о мутациях, произошедших в половых клетках самцов на разных стадиях развития сперматозоидов.
Метод обнаружения доминантных летальных мутаций, как и все другие тесты имеет ряд слабых мест. Для того, чтобы отличить случаи гибели зародышей в результате воздействия испытуемого вещества от гибели под воздействием внешних факторов среды на материнский организм в процессе беременности, результаты эксперимента сравниваются с результатами контрольного опыта, проводящегося одновременно с испытанием в тех же условиях и на таких же животных, как и при исследовании испытуемого вещества. При анализе результатов этих исследований необходимо учитывать системы репарации поврежденной ДНК, имеющиеся не только в сперматозоидах, но и в яйцеклетках, которые могут залечить повреждения, имеющиеся в наследственном аппарате сперматозоидов.
Чтобы повысить достоверность полученных результатов, исследования проводятся на значительном количестве животных и анализируются с помощью статистических методов.
Для того, чтобы повысить чувствительность метода, исследование проводятся на гибридах 1-го поколения F1 специально выбранных для этой линий мышей (CBA*C57Bl6).
Мутагенный эффект проявляется в виде повышенной эмбриональной смертности. Если яйцеклетка оплодотворена сперматозоидом, несущим доминантную леталь, смерть развивающегося эмбриона может произойтикак до, так и после имплантации. В соответствии с рекомендациями Фармакологического государственного комитета МЗ РФ (1999), при оценке мутагенных свойств «Литовита-М» учитывалась постимплантационная смертность.
Использовали гибриды первого поколения мышей F1 (CBA*C57Bl6).
Т.к. БАД к пище «Литовит-М» нетоксичен и показатели ЛД для него не возможно определить, для исследования выбрана доза, равная 100- кратной рекомендуемой дозы для человека.
«Литовит-М» вводили самцам внутрижелудочно, в 1% крахмальном геле в дозе 7 г/кг, равной 100- кратной рекомендуемой суточной дозы для человека.
В опытной и в контрольной группах было по 12 самцов. После введения препарата к каждому самцу подсаживали по 3 интактных виргинных самки. Через 7 дней самок отсаживали, заменяя их новыми. Отсаженных самок вскрывали на 15 – 17 день беременности, производили учет количества живых и мертвых эмбрионов. Повышенная эмбриональная смертность плодов у самок, забеременевших в первую неделю после введения химического вещества свидетельствует о мутационных изменениях в зрелых спермиях, во вторую неделю – в поздних сперматидах, в третью – в ранних сперматидах.
Результаты вскрытия фиксировали для каждой самки отдельно, затем суммировали. Основным показателем уровня доминантных летальных мутаций служил уровень постимплантационных потерь – показатель, характеризующий постимплантационную выживаемость. Его определяли по формуле:
А= d/(I+d),
где d- число погибших эмбрионов; I – число живых эмбрионов.
Определение достоверности различий в опытной и контрольной группах проводилось с помощью критерия х2 по формуле:
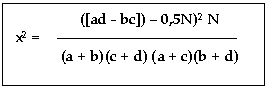
где:
а – мертвые эмбрионы, контроль; b – мертвые эмбрионы, опыт; с – живые эмбрионы, контроль; d – живые эмбрионы, опыт. N = a + b + c + d.
Таблица 24. Результат изучения способности «Литовита-М» индуцировать доминантные летальные мутации в зародышевых клетках мышей.
|
Стадия сперматогенеза |
Доза, г/кг |
Число беременных самок |
Фертильность, % |
Постимплантационные потери |
х2 |
|
Зрелые спермии |
0 |
41 |
91 |
0,04 |
|
|
7,0 |
42 |
93 |
0,04 |
||
|
Поздние сперматиды |
0 |
42 |
93 |
0,05 |
|
|
7,0 |
41 |
91 |
0,04 |
||
|
Ранние сперматиды |
0 |
43 |
95 |
0,04 |
Как видно из таблицы 24, ни в одном случае уровень постимплантационных потерь у животных, подвергавшихся воздействию «Литовита-М» однократно в дозе 7,0 г/кг, не вызвал статистически достоверного превышения этого показателя над контрольными значениями ни в одном из сроков наблюдения.
«Литовит-М» в испытанной дозе не индуцирует доминантные летальные мутации в зрелых спермиях, поздних сперматозоидах и ранних сперматидах у мышей.
НА ОСНОВАНИИ ПРИВЕДЕННЫХ ДАННЫХ МОЖНО СДЕЛАТЬ ВЫВОД, ЧТО «ЛИТОВИТ-М» НЕ ОБЛАДАЕТ МУТАГЕННЫМ ДЕЙСТВИЕМ.
ИССЛЕДОВАНИЕ ЭМБРИОТОКСИЧЕСКИХ И ТЕРАТОГЕННЫХ СВОЙСТВ «ЛИТОВИТА-М»
Исследование эмбриотоксических и тератогенных свойств «Литовита-М», в также оценки его возможного влияния на репродуктивную функцию проведено в соответствии с «Методическими указаниями по изучению репродуктивной токсичности фармакологических веществ» (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ) (стр. 39-46, Москва, 2000 г.).
Эксперименты проведены на 60 беременных крысах Wistar, которые были разделены на 2 группы по 30 животных в каждой: 1 группа – контроль; 2 группа – «Литовит-М» в дозе 1,5 г/кг. «Литовита-М» вводили внутрижелудочно в 1% крахмальном геле в течение всей беременности (с 1 по 19 сутки). Использованная доза «Литовита-М» была равна 20-ти кратной суточной дозе, рекомендованной для человека.
Контрольные животные ежедневно получали с 1 по 19 день беременности соответствующее количество растворителя (1% раствор крахмала). На 20-й день беременности проводили эвтаназию 70% беременных крыс дислокацией шейных позвонков с последующим исследованием костного скелета и внутренних органов плодов, а также для определения показателей предимплантационной гибели по формуле:
Предимплантационная гибель = ((100-Количество мест имплантации)/(Количество желтых тел))*100;
и постимплантационной гибели по формуле:
Постимплантационная гибель = ((100-Количество живых плодов)/(Количество мест имплантации)*100;
После оценки жизнеспособности плодов, определения их массы, проводили анализ внешних аномалий (подкожные кровоизлияния, отек подкожной клетчатки) и пороков развития (искривления конечностей и позвоночного столба, изменения глазных яблок, ушных раковин). После наружного осмотра плодов, одну группу плодов (примерно 2/3) фиксировали в 96% спирте и после просветления раствором щелочи, промывания водой, окрашивали ализарином, обезвоживали в различных смесях глицерина с 96% спиртом и использовали для изучения костного скелета по Доусону.
Другую группу плодов (примерно 1/3) фиксировали в жидкости Буэна и использовали для изучения внутренних органов на микроанатомических срезах по Вильсону – Дыбану (на уровне вибрисс, глазных яблок, боковых и четвертого желудочков головного мозга, выше передних лап, ниже передних лап, на уровне сердца и легких, желудка, печени, почек), исследовали также мочевой пузырь, мочеточники, органы репродуктивной системы.
30% от общего количества беременных самок было оставлено на роды, после которых в течение первого месяца постнатального периода проводили изучение смертности, динамики массы тела и физического развития крысят.
Внутрижелудочное введение беременным самкам «Литовита-М» в дозе 1,5 г/кг не влияло на прибавку массы тела беременных самок по сравнению с контролем (таблица 25).
Таблица 25. Динамика массы тела беременных крыс (% к исходной).
|
Группы животных |
1 неделя |
2 неделя |
3 неделя |
|
Контроль, % |
112,5 ± 4,4 |
132,1 ± 5,1 |
148,3 ± 6,8 |
|
«Литовит М», 1,5 г/кг, % |
114,8 ± 4,8 |
138,8 ± 5,7 |
154,4 ± 7,1 |
Продолжительность беременности, количество живых плодов, масса их тела и кранио – каудальный размер, количество желтых тел, мест имплантации, показатели предимплантационной и постимплантационной гибели у беременных крыс, получавших «Литовит-М» в дозе 1,5 г/кг не отличались от соответствующих показателей у животных контрольной группы (см. таблицу 26).
Таблица 26. Показатели эмбриотоксического действия «Литовита-М» при внутрижелудочном введении крысам с 1 по 19 сутки беременности.
|
Исследуемые показатели |
Группы животных |
|
|
Контроль |
«Литовит-М» 1,5 г/кг |
|
|
Продолжительность беременности, сутки |
22,3 ± 0,2 |
22,1 ± 0,3 |
|
Количество эмбрионов на 1 крысу |
10,9 ± 0,2 |
10,8 ± 0,3 |
|
Количество мест имплантации на 1 крысу |
11,5 ± 0,3 |
11,2 ± 0,3 |
|
Количество желтых тел на 1 крысу |
12,3 ± 0,2 |
12,1 ± 0,2 |
|
Предимплантационная гибель |
6,5 ± 0,7 |
7,1 ± 0,8 |
|
Постимплантационная гибель |
5,2 ± 0,5 |
6,6 ± 0,7 |
|
Кранио- каудальный размер плода |
2,8 ± 0,1 |
2,7 ± 0,2 |
|
Масса плода, г |
2,9 ± 0,2 |
2,8 ± 0,2 |
При макроскопическом осмотре и микроанатомическом исследовании (стандартные разрезы по Вильсону – Дыбану) плодов, подвергавшихся в пренатальном периоде воздействию «Литовита-М» в изучаемой дозе не выявило каких – либо уродств и пороков развития внутренних органов. Частота кровоизлияний в брюшную полость и перикард, число случаев гидронефроза не превышали соответствующих показателей у контрольных животных (см. таблицу 27).
Таблица 27. Частота аномалий развития и кровоизлияний у плодов на 20 сутки пренатального периоды.
|
Исследуемые показатели |
Группы животных |
|
|
Контроль |
«Литовит-М» 1,5 г/кг |
|
|
Кровоизлияния в брюшную полость, абс. % |
2,0 (3,4%) |
4,0 (3,8%) |
|
Гидронефроз, абс. % |
3,0 (3,9%) |
3,0 (3,1%) |
|
Кровоизлияние в перикард, абс. % |
2,0 (3,4%) |
4,0 (3,8%) |
При анализе тотальных препаратов, окрашенных ализарином, для изучения развития костной системы у крысиных плодов не выявлены пороки развития скелета и задержки оссификации при воздействии «Литовита-М» при его внутрижелудочном введении в испытанной дозе (см. таблицу 28).
Таблица 28. Показатели развития костного скелета плодов на 20-е сутки пренатального развития.
|
Отсутствие центров оссификации в скелетах плодов |
Группы животных |
|
|
Контроль |
«Литовит-М» 1,5 г/кг |
|
|
Грудина, абсолютное количество на помет |
2,1 |
2,7 |
|
Подъязычная кость, % |
1,8 |
2,4 |
|
Передняя конечность, % |
||
|
2-я пястная кость |
10,2 |
10,3 |
|
3-я пястная кость |
3,1 |
3,3 |
|
4-я пястная кость |
3,9 |
4,6 |
|
Задняя конечность, % |
||
|
2-я плюсневая кость |
9,6 |
10,1 |
|
3-я плюсневая кость |
5,3 |
5,3 |
|
4-я плюсневая кость |
7,4 |
7,8 |
|
Кости туловища, % |
||
|
Седалищная |
- |
0,3 |
|
Повздошная |
- |
0,5 |
|
Лонная |
2,6 |
3,1 |
При внутрижелудочном введении «Литовита-М» в дозе 1,5 г/кг с 1 по 19 день беременным крысам не установлено влияния препарата на количество родившихся крысят и процент мертворожденных плодов. Показатели смертности крысят, подвергавшихся в пренатальном периоде развития воздействию «Литовита-М» в изучаемой дозе 1,5 г/кг, и динамика массы их тела на протяжении первого месяца жизни не отличались от соответствующих показателей в контроле (см. таблицу 29). Развитие потомства в течение всего периода наблюдения по другим принятым параметрам (покрытие шерстью, появление резцов, открытие глаз, отлипание ушных раковин, время созревания рефлексов и т.д.) происходило без отклонения от сроков, характерных для нормального физиологического развития.
Таблица 29. Показатели постнатального развития крысят, подвергавшихся в пренатальном периоде (с 1 по 19 сутки беременности) воздействию «Литовита-М».
|
Изучаемые показатели |
Группы животных |
|
|
Контроль |
«Литовит-М» 1,5 г/кг |
|
|
Количество родившихся крысят на 1 крысу |
10,8 ± 0,9 |
9,9 ± 1,1 |
|
Постнатальная смертность, % |
0,6 |
0,7 |
|
Масса тела крысят, г |
||
|
При рождении |
5,8 ± 0,5 |
6,1 ± 0,8 |
|
7 сутки жизни |
15,9 ± 1,1 |
16,3 ± 1,5 |
|
14 сутки жизни |
30,2 ± 1,8 |
34,2 ± 1,9 |
|
21 сутки жизни |
51,3 ± 1,7 |
54,6 ± 1,9 |
В заключении следует отметить, что «Литовит-М» в испытанной дозе 1,5 г/кг (20-ти кратная рекомендуемая суточная доза для человека) при внутрижелудочном введении беременным крысам с 1 по 19 сутки гестации не влияет на динамику массы тела беременных крыс и продолжительность беременности. Не установлено влияние «Литовит-М» на количество живых плодов, массу тела и кардио – каудальный размер, на показатели предимплантационной и постимплантационной гибели, а также на постнатальное развитие потомства. «Литовит-М» в испытанной дозе 1,5 г/кг не вызвал задержки развития костной системы плодов, а также каких – либо уродств и пороков развития.
ИЗУЧЕНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА РЕПРОДУКТИВНУЮ ФУНКЦИЮ.
Исследования выполнены на самцах и самках белых крыс Wistar (исходная масса тела 180 – 200 г). Группы самцов и самок, состоявшие, соответственно, из 45 и 90 животных, были разделены на 2 подгруппы: контрольную и опытную. Самцам опытной группы, ежедневно, в течение 10 недель (2-3 цикла созревания сперматозоидов) в желудок вводили «Литовит-М» в дозе 1,5 г/кг в 1% крахмальном геле. Самкам опытной группы препарат вводили в той же дозе в течение 2-х недель (3-4 эстральных цикла). Животные контрольных групп в те же сроки получали соответствующее количество растворителя (1% крахмальный гель). После окончания введения препарата сформировали 3 группы животных:
- первая – к 15 контрольным самцам подсаживали 30 контрольных самок;
- вторая – к 15 подопытным самцам подсаживали 30 контрольных самок;
- третья – к 30 подопытным самкам подсаживали 15 контрольных самцов.
В течение двух эстральных циклов просматривали вагинальные мазки. Отмечали стадии проэструс, эструс, диэструс и метаэструс. Обнаружение в вагинальных мазках сперматозоидов считали первым днем беременности. По истечении 10 дней из беременных самок в каждой из трех групп создавали две подгруппы. Первые подгруппы самок забивали на 20-й день беременности. Подсчитывали количество плодов, резорбций, мест имплантации в полости матки, желтых тел в яичниках. На основании полученных данных вычисляли показатели предимплантационной и постимплантационной гибели по формуле:
Предимплантационная гибель = ((100-Количество мест имплантации)/Количество желтых тел)*100;
Постимплантационная гибель = ((100-Количество живых плодов)/Количество мест имплантации)*100;
а также индекс плодовитости4 и индекс беременности 5.
При осмотре плодов отмечали патологически изменения (подкожные кровоизлияния, отек подкожной клетчатки, нарушения развития скелета, глазных яблок).
Вторые группы беременных самок оставляли на роды, ежедневно наблюдая за животными, 1 раз в неделю их взвешивали и отмечали прибавку массы тела. Фиксировали дату родов, количество крысят в помете и массу тела новорожденных крысят. На 4 день со дня родов вычисляли процент выживаемости. К 7 дню помет редуцировали до 8 голов, определяли индекс выживаемости, отмечали общий и средний вес крысят. При исследовании плодовитости крыс не выявлено уменьшение числа беременных крыс по сравнению с контролем как в группе самок, получавших «Литовит-М», так и в группе самок, беременных от самцов, получавших «Литовит-М» (см. таблицу 30).
Таблица 30. Показатели плодовитости животных, получавших «Литовит-М» в дозе 1,5 г/кг.
|
Исследуемые показатели |
Группы животных |
||
|
Контроль |
Самцы «Литовит-М» 1,5 г/кг |
Самки «Литовит-М» 1,5 г/кг |
|
|
Количество ссаженных самок, абс. |
30,0 |
30,0 |
30,0 |
|
Количество оплодотворенных самок, абс. |
29,0 |
28,0 |
28,0 |
|
Количество беременных самок, абс. |
27,0 |
26,0 |
25,0 |
|
Индекс беременности, % |
92,6 |
92,5 |
92,6 |
|
Индекс плодовитости, % |
93,3 |
90,0 |
93,3 |
Внутрижелудочное введение «Литовита-М» в испытанной дозе не влияло на прибавку массы тела беременных крыс подопытных групп по сравнению с контролем, а также на показатели предимплантационной и постимплантационной гибели эмбрионов (см. таблицу 31).
Таблица 31. Влияние «Литовита-М» при внутрижелудочном введении на репродуктивную функцию крыс.
|
Исследуемые показатели |
Группы животных |
||
|
Контроль |
Самцы «Литовит-М» 1,5 г/кг |
Самки «Литовит-М» 1,5 г/кг |
|
|
Количество беременных самок |
12,0 |
12,0 |
12,0 |
|
Количество желтых тел |
12,6 |
12,2 |
12,1 |
|
Количество мест имплантации |
11,8 |
11,4 |
11,2 |
|
Количество живых плодов |
10,9 |
10,6 |
10,4 |
|
Количество резорбций |
1,8 ± 0,6 |
1,6 ± 0,7 |
1,8 ± 0,4 |
|
Предимплантационная гибель, % |
6,4 |
6,6 |
7,4 |
|
Постимплантационная гибель, % |
7,7 |
7,0 |
7,2 |
Продолжительность беременности и инстинкт материнства у подопытных животных, получавших внутрижелудочно «Литовит-М» в исследуемой дозе не отличались от аналогичных показателей у контрольных животных. При наблюдении за постнатальным развитием потомства не установлено увеличения гибели плодов по сравнению с контрольными показателями.
Масса плодов при рождении и дальнейшая прибавка массы тела новорожденных крысят в первый месяц неонатального развития практически не отличалась от контрольной (см. таблицу 32).
Таблица 32. Показатели постнатального развития крысят при изучении влияния «Литовита-М» в дозе 1,5 г/кг на репродуктивную функцию крыс.
|
Исследуемые показатели |
Группы животных |
||
|
Контроль |
Самцы «Литовит-М» 1,5 г/кг |
Самки «Литовит-М» 1,5 г/кг |
|
|
Количество родившихся крысят на 1 самку, абс. |
10,9 ± 1,4 |
9,8 ± 1,6 |
10,1 ± 1,3 |
|
Масса тела новорожденных крысят, г |
6,2 ± 0,6 |
6,3 ± 0,8 |
6,4 ± 0,4 |
|
Динамика массы тела крысят, г |
|||
|
1-я неделя |
17,2 ± 0,8 |
17,8 ± 0,7 |
17,6 ± 0,6 |
|
2-я неделя |
32,4 ± 1,3 |
32,7 ± 1,7 |
33,8 ± 1,5 |
|
3-я неделя |
45,6 ± 4,8 |
45,8 ± 5,1 |
46,4 ± 4,2 |
Физическое развитие крысят в течение первого месяца постнатального развития (покрытие шерстью, открытие глаз, отлипание ушных раковин, открытие вагины, опускание яичек и т.д.) не отличалось от сроков, характерных для нормального физиологического развития животных этого вида.
В результате проведенных исследований установлено, что внутрижелудочное введение «Литовита-М» в дозе 1,5 г/кг (20-ти кратная рекомендуемая суточная доза для человека), не проявляет эмбриотоксических, тератогенных свойств и не влияет на репродуктивную функцию животных.
ИЗУЧЕНИЕ АЛЛЕРГИЗИРУЮЩИХ СВОЙСТВ «ЛИТОВИТА-М»
Исследование аллергизирующих свойств «Литовита-М» проведено в соответствии с «Методическими указаниями по оценке аллергизирующих свойств фармакологических веществ» (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, Москва, 2000 г.) показало, что в испытанных дозах при 10- кратном нанесении препарата в 1% крахмальном геле не наблюдается явлений сенсибилизирующего действия и контактного дерматита.
В связи с эти, накожное нанесение препарата было продлено еще на 2 недели. Однако и в этом случае реакция всех подопытных животных на длительное сенсибилизирующее действие «Литовита-М» при его накожной аппликации была отрицательной.
Метод накожных аппликаций
Исследования выполнены на 30 пестрых морских свинках с большими белыми участками кожи (самки, масса тела 250 – 300 г), которые были разделены на 3 группы по 10 животных в каждой: 1 группа – контроль; 2 группа – «Литовит-М» 70 мг/кг; 3 группа – «Литовит-М» 700 мг/кг. Примененные дозы «Литовита-М» соответствовали его суточной и 10- кратной суточной дозе, рекомендованной для человека. Из навесок препарата готовили взвеси в 1% крахмальном геле, которые в объемах 0,25 и 0,8 мл (70 и 700 мг/кг) наносили на выстриженные участки боковой поверхности туловища (2*2 см) морских свинок 5 раз в неделю в течение двух недель. Контрольным животным в те же сроки наносили по 0,8 мл 1% крахмального геля. Реакцию кожи учитывали ежедневно по шкале проб Г. В. Суворова (1974 г.).
Реакция специфического лизиса лейкоцитов
Реакция специфического лизиса лейкоцитов основана на участии комплимента в реализации формирования иммунного комплекса на поверхности клеток и приводящего к их повреждению и лизису (Никитин В.М., 1982 г.).
Исследования выполнены на 30 пестрых морских свинках (самцы, масса тела 250 – 300 г), разделенных на 3 группы по 10 животных в каждой: 1 группа – контроль; 2 – группа – «Литовит-М» 70 мг/кг; 3 группа – «Литовит-М» 700 мг/кг. Животных 2-й и 3-й подопытных групп сенсибилизировали ежедневным в течение 4-х недель пероральным введением взвеси изучаемого препарата в 1% крахмальном геле. Испытанные дозы «Литовита-М» соответствовали его суточной и 10- кратной суточной дозе, рекомендованной для человека.
Животным контрольной группы в течение этого срока вводили в желудок соответствующее количество растворителя (1% крахмального геля). Тестирование проводили на следующий день после окончания введения препарата.
У животных из ушной вены брали кровь в объеме 0,3 мл в укороченные пробирки, содержащие цитрат натрия, добавляли по 0,05 мл 10 – дневного настоя «Литовита-М» на стерильном физиологическом растворе (1:10) (в качестве рабочей дозы аллергена). Контрольные пробирки содержали антикоагулянт, кровь сенсибилизированного (или контрольного) животного и физиологический раствор без аллергена. Пробирки инкубировали в течение двух часов в термостате при температуре 370С периодически встряхивая. Для разрушения эритроцитов добавляли 0,2 мл 3% уксусной кислоты, для окраски лейкоцитов 0,2 мл 1% генцианфиолетового. В опытных и контрольных пробах под микроскопом в камере Горяева подсчитывали лейкоциты и вычисляли показатель реакции специфического лизиса лейкоцитов.
В таблице 33 представлена оценка аллергизирующего действия «Литовита-М» при проведении реакции специфического лизиса лейкоцитов.
Таблица 33. Оценка аллергизирующего действия «Литовита-М» при проведении реакции специфического лизиса лейкоцитов
|
Группы животных |
Сенсибилизирующие дозы (мг/кг) |
Показатель специфического лизиса лейкоцитов (%) |
|
Контроль |
- |
7,9 ± 1,8 |
|
«Литовит-М» |
70,0 |
8,4 ± 2,1 |
|
«Литовит-М» |
700,0 |
9,7 ± 2,2 |
ИССЛЕДОВАНИЕ ИММУНОТОКСИЧЕСКИХ СВОЙСТВ БАД К ПИЩЕ «ЛИТОВИТ-М»
Изучение возможных иммунотоксических свойств БАД к пище «Литовит-М» проведено в соответствии с «Методическими указаниями по оценке иммунотоксического действия фармакологических веществ» (Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, Москва, 2000 г.).
Оценка влияния «Литовита-М» на массу и клеточность лимфоидных органов
При изучении влияния «Литовита-М» не массу и клеточность лимфоидных органов эксперименты проведены на 30 мышах BALB/c (самцы, масса тела 18 20 г), которые были разделены на 3 группы по 10 животных в каждой: 1 группа – контроль; 2 – группа – «Литовит-М» 70 мг/кг; 3 группа – «Литовит-М» 700 мг/кг. Препарат в указанных дозах вводили в желудок в течение 14 дней в 1% крахмальном геле. Контрольные животные получали соответствующее количество растворителя. Примененные дозы «Литовита-М» были равны суточной и 10- кратной суточной дозе, рекомендованной для человека. Лимфоидные органы (селезенка, тимус, подчелюстные лимфатические узлы, костный мозг бедренных костей) выделяли на 7 сутки после последнего введения «Литовита-М».
Перечисленные иммунокомпетентные органы мышей (кроме трубчатых костей) взвешивали и определяли коэффициенты их массы (К) по формуле:
К = ((Масса органа, г)/(Масса животного, г))*100%;
Перечисленные иммунокомпетентные органы мышей (кроме трубчатых костей) взвешивали и определяли коэффициенты их массы.
Для определения клеточности костный мозг после вымывания из бедренных костей и указанные лимфоидные органы дезинтегрировали в гомогенизаторе типа тефлон – стекло со средой 199. Суспензию клеток отделяли от элементов стромы фильтрованием через 2- слойный капроновый фильтр, троекратно отмывали и центрифугировали при 200 g в течение 5 минут. После лизиса клеток эритроидного ряда 3% уксусной кислотой в полученной суспензии подсчитывали количество кариоцитов на счетчике клеток «Пикоскель» (Венгрия). Для определения вероятности спонтанной гибели клеточных элементов всю процедуру выделения клеток проводили на холоду. Для определения количества жизнеспособных клеток к 20 мкл (5*106 клеток/мл) полученной выше охлажденной клеточной суспензии добавляли равный объем 0,1% раствора эозина в 0,15М растворе NaCl и через 10 минут под микроскопом в камере Горяева подсчитывали сило окрашенных (погибших) клеток на 200 мл клеточных элементов в поле зрения.
Процент (Р) жизнеспособных (неокрашенных клеток) высчитывали по формуле:
Р = ((Число живых клеток)/(Число живых клеток + Число погибших клеток))*100%;
Результаты серии экспериментов по оценке влияния «Литовита-М» на массу и клеточность лимфоидных органов представлены в таблице 34.
Таблица 34. Влияние «Литовита-М» при 14- дневном введении в желудок мышам BALB/c на массу и клеточность лимфоидных органов.
|
Группы животных, органы |
Коэффициент массы, % |
Количество кариоцитов, млн/мг ткани |
% жизнеспособных клеток |
|
Селезенка |
|||
|
1. Контроль |
0,48 ± 0,02 |
0,64 ± 0,03 |
94,6 ± 1,3 |
|
2. «Литовит-М» 70 мг/кг |
0,45 ± 0,03 |
0,59 ± 0,02 |
96,4 ± 2,3 |
|
3. «Литовит-М» 700 мг/кг |
0,46 ± 0,03 |
0,56 ± 0,04 |
93,8 ± 2,4 |
|
Тимус |
|||
|
1. Контроль |
0,19 ± 0,006 |
0,60 ± 0,06 |
97,6 ± 0,9 |
|
2. «Литовит-М» 70 мг/кг |
0,18 ± 0,007 |
0,56 ± 0,04 |
94,8 ± 2,1 |
|
3. «Литовит-М» 700 мг/кг |
0,19 ± 0,009 |
0,58 ± 0,07 |
95,0 ± 2,4 |
|
Подчелюстные лимфоузлы |
|||
|
1. Контроль |
0,03 ± 0,002 |
0,58 ± 0,06 |
95,8 ± 1,3 |
|
2. «Литовит-М» 70 мг/кг |
0,04 ± 0,003 |
0,48 ± 0,05 |
97,2 ± 1,4 |
|
3. «Литовит-М» 700 мг/кг |
0,04 ± 0,003 |
0,52 ± 0,07 |
94,8 ± 0,9 |
|
Костный мозг |
|||
|
1. Контроль |
0,48 ± 0,09 |
97,6 ± 2,3 |
|
|
2. «Литовит-М» 70 мг/кг |
0,52 ± 0,06 |
95,8 ± 1,9 |
|
|
3. «Литовит-М» 700 мг/кг |
0,46 ± 0,08 |
94,6 ± 2,1 |
|
На основании полученных данных можно сделать вывод о том, что в испытуемых дозах 70 и 700 мг/кг при 2- недельном введении в желудок «Литовит-М» не влияет на коэффициент массы таких иммунокомпетентных органов, как селезенка, тимус, подчелюстные лимфоузлы, а также количество кариоцитов и их жизнеспособность в селезенке, тимусе, подчелюстных лимфоузлах и костном мозге бедренных костей.
ИЗУЧЕНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА РЕАКЦИЮ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА показало, что «Литовит-М» в испытанных дозах 70 и 700 мг/кг не влияет на формирование реакции гиперчувствительности замедленного типа к эритроцитам барана.
Для оценки влияния «Литовита-М» на клеточный иммунитет животных использовали реакцию гиперчувствительности замедленного типа к эритроцитам барана. Исследования выполнены на 40 мышах – гибридах F 1 (CBA*C 57 Bl 6 ) (самцы, масса тела 19-20 г), которые были разделены на 4 группы, по 10 животных в каждой: 1 группа – интактный контроль; 2 группа – контроль растворителя; 3 группа – «Литовит-М» 70 мг/кг; 4 группа – «Литовит-М» 700 мг/кг. Использованные дозы «Литовита-М» были равны суточной и 10- кратной суточной дозе, рекомендованной для человека. Изучаемый препарат в указанных дозах вводили ежедневно в течение 7 дней в желудок мышам в 1% крахмальном геле. Животные 2-ой контрольной группы получали в желудок соответствующее количество растворителя. Животные 1 контрольной группы служили интактным контролем.
После окончания введения «Литовита-М» и растворителя мышей всех групп иммунизировали подкожным введением в межлопаточную область эритроцитов барана в дозе 2*108. Разрешающую дозу антигена (0,05 мл суспензии эритроцитов барана, содержащей 1*108 клеток) вводили субплантарно в заднюю лапу животных на 5-е сутки после первой иммунизации. В контрольные лапы мышей (контроль) различных групп вводили по 0,05 мл стерильного физиологического раствора. Результаты реакции регистрировали через 24 часа путем измерения толщины лапы микрометром МК-025. Разница в толщине опытной и контрольной лап характеризовала величину отека и интенсивность реакции гиперчувствительности замеленного типа.
Влияние «Литовита-М» при 7- дневном введении в желудок мышам – гибридам F 1 (CBA*C 57 Bl 6 ) на развитие реакции гиперчувствительности замедленного типа к эритроцитам барана представлен в таблице 35.
Таблица 35. Влияние «Литовита-М» при 7- дневном введении в желудок мышам – гибридам F 1 (CBA*C 57 Bl 6 ) на развитие реакции гиперчувствительности замедленного типа к эритроцитам барана.
|
Группа животных, испытуемые дозы «Литовит-М» |
Индекс реакции |
|
1. Интактный контроль |
0,35 ± 0,07 |
|
2. Контроль растворителя |
0,37 ± 0,05 |
|
3. «Литовит-М» 70 мг/кг |
0,41 ± 0,05 |
|
4. «Литовит-М» 700 мг/кг |
0,39 ± 0,04 |
ИССЛЕДОВАНИЕ ВЛИЯНИЯ «ЛИТОВИТА-М» НА КОЛИЧЕСТВО АНТИТЕЛОБРАЗУЮЩИХ КЛЕТОК показало, что «Литовит-М» в испытанных дозах 70 и 700 мг/кг не влияет на количество антителобразующих клеток в селезенке мышей, иммунизированных эритрофитами барана.
Для изучения влияния «Литовита-М» на накопление антителобразующих клеток (АОК) в селезенке мышей, использовали прямой метод локального гемолиза, который позволяет определить клетки, образующие иммуноглобулин – М – антитела с высокой гемолитической активностью (Jerne N. K., Nordin A. A. Sciense, 1963, v140, p 405).
Исследования выполнены на 30 мышах СВА (самцы, масса тела 18-20 г), которые были разделены на 3 группы по 10 животных в каждой: 1 группа – контроль; 2 группа – «Литовит-М» 70 мг/кг; 3 группа – «Литовит-М» 700 мг/кг. Испытанные дозы «Литовита-М» соответствовали суточной и 10- кратной суточной дозе, рекомендуемой для человека.
На первом этапе эксперимента мышей иммунизировали внутривенным введением эритроцитов барана, отмытых в стерильном физиологическом растворе, в дозе 1*108 клеток/ мышь. Животным 2 и 3 подопытных групп в день иммунизации вводили в желудок изучаемый препарат в 1% крахмальном геле в дозах 70 и 700 мг/кг, животным контрольной группы – 1% крахмальный гель. Через 4 суток после иммунизации животных забивали дислокацией шейных позвонков, выделяли селезенку, гомогенизировали и гомогенизаторе стекло/ стекло в растворе Хенкса, на холоду, в объеме 5 мл. Приготовленную суспензию фильтровали через 1 слой капрона и помещали в холодильник. Из полученной суспензии готовили взвесь спленоцитов 1*107 клеток/ мл в среде Хенкса. Использовали клеточные суспензии с 85% жизнеспособных клеток. Далее выполняли метод локального гемолиза, описанный в «Методических указаниях по оценке иммунотоксического действия фармакологических веществ», М., 2000. Зоны гемолиза подсчитывали с помощью микроскопа МБС – 9. Подсчет антителобразующих клеток осуществляли на 1*104 спленоцитов, индивидуально для каждой мыши.
Влияние «Литовита-М» на количество антителобразующих клеток у мышей линии СВА, иммунизированных эритроцитами барана представлены в таблице 36.
Таблица 36. Влияние «Литовита-М» на количество антителобразующих клеток у мышей линии СВА, иммунизированных эритроцитами барана.
|
Группы животных, испытанные дозы «Литовита-М» |
Количество антителобразующих клеток на 1*104 спленоцитов |
|
1. Контроль |
12,8 ± 2,1 |
|
2. «Литовит-М» 70 мг/кг |
14,2 ± 1,9 |
|
3. «Литовит-М» 700 мг/кг |
13,1 ± 2,3 |
ИССЛЕДОВАНИЕ ВЛИЯНИЕ «ЛИТОВИТА-М» НА ФАГОЦИТАРНУЮ АКТИВНОСТЬ НЕЙТРОФИЛОВ показало, что «Литовит-М» в испытанных дозах 70 и 700 мг/кг умеренно повышает фагоцитарную активность нейтрофилов. Определение фагоцитарной активности нейтрофилов мышей, получавших «Литовит-М» проводили по Штельцнер А. (ред. Фримель Г., в кн. «Иммунологические методы», М., 1987, с. 378-390). Исследования выполнены на 30 мышах СВА (самцы, масса тела 18 – 20 г), которые были разделены на 3 группы по 10 животных в каждой: 1 группа – контроль; 2 группа – «Литовит-М» 70 мг/кг; 3 группа – «Литовит-М» 700 мг/кг. Животным 2 и 3 подопытных групп однократно вводили в желудок изучаемый препарат в указанных дозах на 1% крахмальном геле. Животные контрольной группы получали соответствующее количество растворителя. Через 24 часа у животных брали кровь из ретроорбитального синуса. В пробирки с кровью и антикоагулянтом (цитрат натрия) добавляли взвесь суточной культуры
золотистого стафилококка и термостатировали при 370С. После микроскопии мазков крови, изготовленных из образцов крови через 30 и 60 минут их инкубации со стафилококками и окрашенными по Романовскому – Гимза, определяли: фагоцитарный индекс (% клеток, вступивших в фагоцитоз, от общего количества нейрофилов).
Анализ данных влияния «Литовита-М» на фагоцитарный индекс нейтрофилов (таблица 37) свидетельствует, что «Литовит-М» в испытанных дозах 70 и 700 мг/кг умеренно повышает фагоцитарную активность нейтрофилов.
Таблица 37. Влияние «Литовита-М» на фагоцитарный индекс нейрофилов.
|
Группы животных, испытанные дозы «Литовита-М», время инкубации |
Фагоцитарный индекс |
|
30 минут инкубации |
|
|
1. Контроль |
90,0 ± 1,2 |
|
2. «Литовит-М» 70 мг/кг |
92,0 ± 1,1 |
|
3. «Литовит-М» 700 мг/кг |
98,0 ± 2,1 |
|
60 минут инкубации |
|
|
1. Контроль |
95,0 ± 1,4 |
|
2. «Литовит-М» 70 мг/кг |
99,0 ± 0,9 |
|
3. «Литовит-М» 700 мг/кг |
105,0 ± 1,1 |
ЗАКЛЮЧЕНИЕ О БЕЗОПАСНОСТИ БАД к пище «ЛИТОВИТ-М»
Подводя итоги токсикологического изучения «Литовита-М», предложенного в качестве энтеросорбента, следует отметить, что препарат является практически нетоксичным веществом как при однократном, так и при длительном введении в больших дозах лабораторным животным.
В связи с нерастворимостью «Литовита-М» в воде его токсичность при однократном и повторном введении лабораторным животным исследовали только при назначении в желудок. Проведенные исследования показали, что однократное введение «Литовита-М» в виде взвеси в 1% крахмальном геле в желудок мышам BALB/c и крысам Wistar в диапазоне испытанных доз 500 – 30000 мг/кг не вызывает признаков интоксикации и гибели животных. Следует отметить, что высшая из испытанных доз препарата – 30000 мг/кг более чем в 420 раз превышала суточную дозу – 5,0 г (70 мг/кг), рекомендованную для человека.
Низкая токсичность «Литовита-М» была подтверждена при 3-кратном повторном введении с интервалом 4 часа в желудок мышам BALB/c в дозе 20000 мг/кг. Суммарная доза «Литовита-М» в этом эксперименте составляла 60000 мг/кг, что более, чем в 850 раз превышала суточную терапевтическую дозу для человека. При этом не удалось установить показателей средних смертельных доз ЛД 50 .
Изучение токсичности «Литовита-М» в условиях хронических экспериментов проведено на крысах Wistar при 6 – месячном введении субстанции препарата в желудок в дозах 1,5 и 3,0 г/кг и на собаках при 3- месячном назначении внутрь БАД к пище «Литовит-М» в дозе 1,05 г/кг. Указанные дозы «Литовита-М», соответственно, в 20, 40 и 15 раз превышали рекомендуемую суточную дозу для человека.
Как показали проведенные исследования, «Литовит-М» в испытанных доза 1,5; 3,0 и 1,05 г/кг хорошо переносится животными в хронических экспериментах и не влияет на гематологические показатели, функциональное состояние органов и систем организма (по данным биохимических тестов и ЭКГ).
Отсутствие влияния при длительном внутрижелудочном введении «Литовита-М» крысам Wistar и собакам в испытанных дозах 1,5 и 3,0 г/кг (крысы) и 1,05 г/кг (собаки) на функциональное состояние важнейших органов и систем организма было подтверждено результатами патоморфологических исследований, показавших отсутствие токсических повреждений внутренних органов, общих и местных токсических и токсико – аллергических реакций, связанных с действием БАД к пище «Литовит-М» в испытанных дозах.
В результате проведенных исследований мутагенных свойств «Литовита-М» с изучением способности препарата вызывать генные мутации у индикаторных штаммов в тесте Эймса, а также вызывать хромосомные аберрации в клетках костного мозга млекопитающих; влиять на количество доминантных леталий в зародышевых клетках мышей, установлено, что «Литовит-М» не обладает мутагенными свойствами.
Изучение эмбриотоксичности и тератогенности «Литовита-М» показало, что препарат в испытанной дозе 1,5 г/кг при внутрижелудочном введении беременным крысам с 1 по 19 день беременности не влияет на динамику массы тела подопытных животных, продолжительность беременности, количество живых эмбрионов, их массу и кранио- каудальный размер тела, не повышает показателей пред- и постимплантационной гибели плодов. «Литовит-М» не вызывает задержки развития костной системы эмбрионов, а также каких -либо уродств и пороков развития.
При ежедневном внутрижелудочном введении «Литовита-М» в дозе 1,5 г/кг крысам – самцам в течение 10 недель и крысам – самкам в течение 2 недель не установлено влияния «Литовита-М» на репродуктивную функцию.
При изучении аллергизирующих свойств «Литовита-М» установлено, что в диапазоне испытанных доз и схем сенсибилизации препарат не обладает аллергизирующим действием. При использовании метода накожных аппликаций и в реакции специфического лизиса лейкоцитов в испытанных дозах не индуцирует аллергические реакции и не является потенциальным аллергеном.
В испытанных дозах 70 и 700 мг/г (1- и 10- кратные суточные дозы, рекомендованные для человека) и схемах введения «Литовит-М» не влияет на массу и клеточность лимфоидных органов мышей, на реакцию гиперчувствительности замедленного типа, на количество антителобразующих клеток, повышая при этом фагоцитарную активность нейтрофилов.
Повышение фагоцитарной активности нейтрофилов требует дальнейшего изучения.
Т.О., ПРИ ДОКЛИНИЧЕСКОМ ТОКСИКОЛОГИЧЕСКОМ ИЗУЧЕНИИ «ЛИТОВИТА-М» НЕ ВЫЯВЛЕНО ПРОТИВОПОКАЗАНИЙ ДЛЯ ПРОВЕДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ ПРЕПАРАТ В КАЧЕСТВЕ ЭНТЕРОСОРБЕНТА В РЕКОМЕНДУЕМОЙ СУТОЧНОЙ ДОЗЕ 70 МГ/КГ (2,5 Г В СУТКИ: ПО 1,25 Г 2 РАЗА В ДЕНЬ).
_____________
3 Доминантные летальные мутации – генетические изменения, индуцированные в родительских зародышевых клетках и приводящие к гибели первое поколение потомков на эмбриональных стадиях развития.
4 Индекс плодовитости – соотношение количества подсаженных к самцам самок к количеству самок, у которых определялись сперматозоиды в вагинальных мазках.
5 Индекс беременности – соотношение количества самок, у которых определялись сперматозоиды в вагинальном мазке к количеству животных, доносивших беременность.
