Сенникова Ю.А., Гришина Л.В., Гельфгат Е.Л., Соловьева Н.Ю., Киселев С.В., Крысов С.В., Сенников С.В., Козлов В.А.
ГУ НИИ Клинической Иммунологии СО РАМН, г. Новосибирск, Россия.
Введение
Проблема последствий радиационного воздействия на здоровье населения Алтайского края в результате деятельности Семипалатинского полигона приобрела в последнее время особую актуальность. Установлено превышение смертности и распространенности заболеваний среди облученного населения Алтайского края над спонтанным уровнем. Определена зависимость «доза-эффект» для ряда заболеваний [3].
В ответ на экстремальное воздействие радиации развиваются многообразные патологические процессы, затрагивающие различные системы и органы человека. Иммунная система обладает высокой чувствительностью к воздействию ионизирующего излучения [5, 6]. Воздействие ионизирующей радиации сопровождается развитием ряда изменений в иммунной системе на клеточном и субклеточном уровне, а формирующиеся дефекты лежат в основе патогенеза целого ряда заболеваний.
К последствиям воздействия на организм ионизирующего облучения относят рост онкологических заболеваний, увеличение частоты аллергических заболеваний, увеличение числа хронических воспалительных заболеваний разной локализации. В патогенезе всех этих заболеваний участвует иммунная система, которая является одной из главных мишеней негативного влияния ионизирующего облучения на организм [4].
Целью настоящей работы явилось изучение отдаленных последствий радиационного воздействия в малых дозах на состояние иммунной системы человека.
Материалы и методы
Исследования проводились в Угловском районе Алтайского края, подвергшемся радиационному воздействию в результате испытания ядерного оружия на Семипалатинском полигоне. Обследованы лица, непосредственно находившиеся на данной территории в период 1949-1962 гг. и проживающие в следующих населенных пунктах: с. Топольное с эффективной эквивалентной дозой (ЭЭД) 157,1 сЗв, условно обозначенное нами как 1-я зона; с. Беленькое и с. Наумовка - ЭЭД 121,6 и 122,8 сЗв соответственно, принятые за 2-ю зону; с. Лаптев Лог с ЭЭД радиационного воздействия 63,3 сЗв, принятое за 3-ю зону. Возраст данных лиц на момент обследования составлял 49-80 лет.
Распространенность основных иммунопатологических синдромов изучалась при обследовании 346 жителей Угловского района. Была использована разработанная в ГУ НИИ КИ СО РАМН автоматизированная система оценки индивидуального риска иммунопатологических состояний – «АСИРИС» [Гельфгат], которая позволяет путем обработки на персональном компьютере результатов анкетирования определить для каждого индивида обследуемой группы количественную меру выраженности того или иного иммунопатологического синдрома.
В качестве контроля использованы результаты обследования 5890 человек – жителей различных регионов Сибири. Предлагаемая система «АСИРИС» позволяет выявить 5 основных типов иммунопатологических синдромов: инфекционный, аллергический аутоиммунный, гематологический, онкологический.
С помощью системы “АСИРИС” выявлялись различные формы иммунопатологических синдромов, в том числе определенные и вероятные, которые указывают на сформировавшийся патологический синдром по совокупности анамнестических признаков, в случае определеннной формы патологического синдрома сведения подтверждены диагнозом. Донозологические и малые формы указывают на наличие ряда симптомов, которые по совокупности не отражают полной клинической картины патологического синдрома.
Мононуклеарные клетки периферической крови (МНК ПК) выделяли стандартно путем центрифугирования гепаринизированной венозной крови в градиенте плотности фиколл-урографина (r=1,082) (фиколл - Pharmacia Fine Chemicl, Швеция, и урографин - Schering, Германия) при 1500 оборотов/мин. в течение 40 минут. Клетки, собранные из интерфазы, помещали в силиконизированные пробирки с 6 мл среды RPMI-1640 с 1% эмбриональной телячьей сыворотки (ЭТС). Этой средой отмывали клетки 3 раза путем ресуспендирования и последующего центрифугирования при 1000 оборотов/мин. в течение 10 минут.
Культивирование МНК ПК осуществлялось в 24-луночных плоскодонных планшетах (Costar, США). В каждую лунку помещался 1 мл полной культуральной среды (RPMI-1640 c добавлением 10% ЭТС, гентамицина 100 мкг/мл, 2 ммоль/л L-глутамина, 5х10-5 моль/л меркаптоэтанола, 20 ммоль/л HEPES), содержащий 1 миллион клеток. Для стимуляции МНК ПК использовали Конканавалин А (Кон А) (Sigma, США) в концентрации 10 мкг/мл.
Время культивирования – 48 часов при температуре 37ºС во влажной атмосфере с 5% СО2. Перед сбором кондиционной среды клетки осаждали центрифугированием в планшетах при 1000 оборотов/мин. в течение 10 мин. Собранные пробы хранились при температуре –20оС до определения в них содержания цитокинов.
Субпопуляционную структуру иммунокомпетентных клеток периферической крови исследовали методом проточной цитофлюориметрии с помощью моноклональных антител. Иммунофенотипирование клеток периферической крови проводили на проточном цитофлюориметре FACSCalibur (Becton Dickinson, США) в программе CellQuest (Becton Dickinson, США).
Использовали моноклональные антитела, меченные флюоресцентными метками – фикоэритрином (PE) или флуоресцеинизотиоцианатом (FITC) для определения экспрессии антигенов CD3, CD4, CD8, CD16, CD20 (МедБиоСпектр, Россия).
Пролиферативную активность мононуклеарных клеток периферической крови определяли стандартным методом. Выделенные МНК ПК культивировали в объеме 150 мкл в круглодонных 96-луночных планшетах (Costar, США) в конечной концентрации 0,15´106 клеток на лунку. Для стимуляции пролиферативного ответа МНК использовали Кон А в конечной концентрации 10 мкг/мл.
Интенсивность пролиферации оценивали через 72 часа по включению 3Н-тимидина в нуклеопротеидные фракции клеток. Н3-тимидин вносили по 1 мкКи/лунку за 6 часов до конца культивирования, клетки осаждали на фильтры с помощью прибора Cell Harvester (Flow Laboratories, Великобритания). Подсчёт радиоктивности экспериментального материала производили в жидкостном сцинтиляционном счётчике SL-30 (Intertechnic, Франция). Результаты представили в виде среднего счёта (импульсы/мин.) из трёх идентичных культур.
Концентрация цитокинов определялась электрохемилюменисцентным методом при использовании «ORIGEN-Analyser» (IGEN Inc., USA) по методике, описанной ранее [9]. Поликлональные и моноклональные антитела приобретались у фирмы R&D Systems (Великобритания). Для построения калибровочных кривых были использованы рекомбинантные цитокины человека ИЛ-2, ИЛ-4, ИЛ-10 (R&D Systems, Великобритания) и ИФНg (Thomae-Biberach/Riss, Германия).
Для статистической проверки гипотез о достоверности различий между группами данных использовались непараметрические критерии Манн-Уитни, Колмогорова-Смирнова, критерий таблицы 2Х2, так как исследуемые выборки не подчинялись нормальному распределению. Данные представлены в виде средней и стандартной ошибки средней (M±m) и в виде медианы (Ме) и размаха квартилей.
Результаты и обсуждение.
В результате проведенных исследований по системе «АСИРИС» установлено, что различные формы иммунопатологических синдромов(ИПС) выявлены у 95,3 % обследованных, что достоверно выше в сопоставлении со стандартом, разработанным для населения Сибири (79,6 %) (рис.1А). Частота выявляемости определенных и вероятных иммунопатологических синдромов ( 58,7 %) у жителей Угловского района также оказалась достоверно выше, чем в контрольной группе (р<0,001).
В дальнейшем анализировалась частота встречаемости только определенных и вероятных иммунопатологических синдромов, для которых можно говорить уже о сформированной иммунопатологии. Анализ структуры иммунопатологических синдромов у жителей Угловского района выявил достоверное повышение частоты встречаемости всех форм ИПС в сравнении с контролем, причем наибольшие значения определялись для аутоиммунного (36,3 %) и инфекционного (23,2 %) синдромов (рис.1В).
В целом, можно заключить, что у лиц, непосредственно попавших под след ядерного взрыва августа 1949 наблюдается повышение частоты инфекционного, аутоиммунного, аллергического, гематологического и онкологического синдромов в сравнении с населением Сибири. Этот факт может свидетельствовать о наличии дефектов в иммунной системе у обследуемой группы.

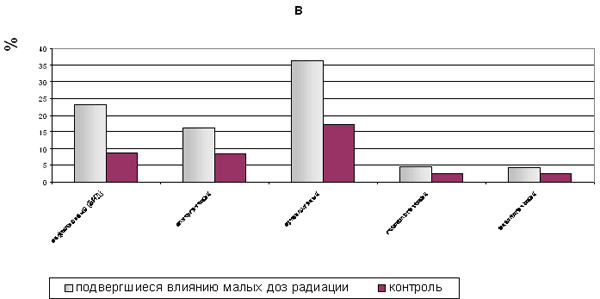
Рис. 1. Распространенность иммунопатологических синдромов (ИПС) у лиц, подвергшихся влиянию малых доз радиации:
А – общая характеристика распространенности ИПС;
В – структура ИПС.
Примечание: *** - имеется статистически значимое различие с контрольной группой р<0,001.
Анализ субпопуляционной структуры иммунокомпетентных клеток периферической крови в обследованных группах выявил рост содержания клеток с фенотипом CD3+ с увеличением дозы радиационного воздействия (рис. 2).
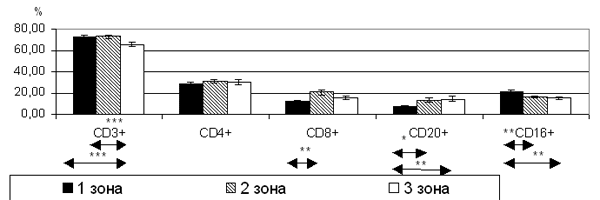
Рис. 2. Субпопуляционная структура иммунокомпетентных клеток периферической крови жителей Угловского района (M±m).
- статистически достоверное различие между исследуемыми группами при * - р<0,05; ** - p<0,01; *** - p<0,001.
Статистически значимых изменений в содержании субпопуляции Т-хелперов (CD4+) во всех трех исследуемых зонах не обнаружено. Содержание клеток, экспрессирующих CD8, снижено у жителей 1-й зоны в сравнении с содержанием этих клеток у жителей 2-й зоны. Различий в содержании CD8+ клеток у лиц, проживающих в 3-й зоне, не выявлено.
Содержание CD16+ клеток периферической крови у обследованных лиц возрастает с увеличением дозы радиационного воздействия. У жителей 1-й зоны эти различия достигают достоверных значений в сравнении с другими обследуемыми группами.
Изучение содержания CD20+ клеток в периферической крови у обследуемых лиц из разных зон выявило, что с ростом ЭЭД происходит снижение этого показателя, причем у жителей проживающих в 1-й зоне (наибольшее значение ЭЭД) этот показатель достоверно снижается в сравнении с группой лиц из 2-й и 3-й зон.
Таким образом, полученные результаты свидетельствуют об изменениях субпопуляционной структуры иммунокомпетентных клеток в отдаленные сроки у лиц, подвергшихся влиянию малых доз радиации. Наиболее значимые изменения выявлены в содержании CD3+ и CD16+ клеток, количество которых возрастает с увеличением дозы радиационного воздействия, и CD20+ клеток, для которых прослеживается тенденция к снижению.
Функциональные свойства лимфоцитов оценивались по пролиферативной активности МНК ПК и их способности к продукции иммунорегуляторных цитокинов in vitro (ФНО-a, ИЛ-2 и ИЛ-4). Установлено, что пролиферативная активность МНК ПК в ответ на митоген (КонА) повышается с возрастанием дозы радиационного воздействия, причем различия показателя достоверны между всеми зонами (рис. 3).
Высшие значения КонА–индуцированной пролиферативной активности зарегистрированы у жителей 1- зоны (максимальная ЭЭД). Следует отметить, что контрольную группу для обследуемого контингента облученных лиц, возраст которых составляет свыше 49 лет подобрать практически невозможно, но если показатели пролиферативной активности МНК ПК у обследуемых сравнить с группой условно здоровых доноров (средний возраст 25-30 лет), они оказываются достоверно выше (данные не приводятся). Полученные результаты свидетельствуют об изменениях в функциональном состоянии МНК ПК.
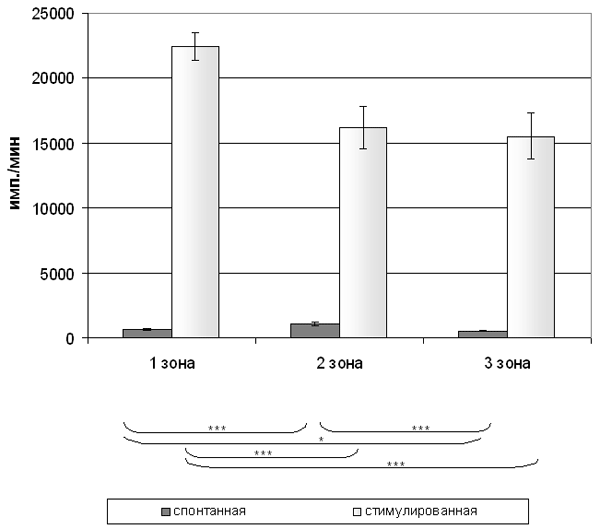
Рис. 3. Спонтанная и митогениндуцированная пролиферативная активность мононуклеарных клеток периферической крови у жителей Угловского района (M±m).
Различие с контрольной группой статистически достоверно:
* - р<0,05; ** - p<0,01; *** - p<0,001.
Данный факт находит отражение и в изменении способности иммунокомпетентных клеток к продукции основных иммунорегуляторных цитокинов. Так во всех обследованных группах, КонА стимулировал МНК ПК к мощнейшей продукции ФНО-a (табл. 1) - 6218,6 - 7132,1 пг/мл, в несколько десятков раз превосходящей показатель в группе условно здоровых доноров (199,0 пг/мл).
Таблица1
Спонтанная и митогениндуцированная продукция цитокиновмононуклеарными клетками периферической крови лиц, подвергшихся воздействию малых доз радиации (M±m)
Продукция цитокинов, пг/мл |
1 зона (n=28) |
2 зона (n=29) |
3 зона (n=24) |
ФНО-a спонт. |
215,0±156,34 |
643,7±494,55 |
1155,0±471,80 |
ФНО-a стимул. |
7132,1±1078,44 |
6218,6±957,93 |
7049,7±1483,2 |
ИЛ-4 спонт.. |
2399,5±455,97 |
913,5±164,67 |
606,3±182,85 |
ИЛ-4 стимул. |
4119,9±894,95 |
1434,3±294,82 |
552,6±162,51 |
ИЛ-2 спонт. |
218,1±137,1 |
231,6±91,57 |
603,8±99,2 |
ИЛ-2 стимул. |
265,9±153,27 |
129,7±46,78 |
559,9±131,55 |
Эти данные согласуются с данными полученными ранее, в которых показано, что у жителей Угловского района с увеличением ЭЭД возрастает процент лиц с положительной экспрессией мРНК провоспалительных цитокинов, в том числе ФНО-a, в интактных МНК ПК. Поскольку ФНО-a является маркером воспаления, способность клеток к его гиперпродукции на стимулирующий фактор несомненно является предрасположением к хронизации воспалительных процессов.
При оценке продукции цитокинов Тх1 и Тх2 типов в культуре МНК ПК наблюдается иная картина (табл. 1). Показано, что МНК ПК исследуемых лиц не отвечают на стимуляцию митогеном продукцией цитокинов Тх1 и Тх2 типа, необходимых для формирования полноценного гуморального и клеточного иммунного ответа. Эти изменения функциональных свойств иммунокомпетентных клеток могут приводить к выраженной воспалительной реакции за счет повышенной продукции ФНО-a на антигенные стимулы и к формированию неполноценного гуморального и клеточного иммунного ответа, так как стимуляции продукция цитокинов Тх1 и 2 типа этими клетками в ответ на митоген не регистрируется.
При исследовании сывороточного уровня цитокинов наиболее выраженные изменения были обнаружены для провоспалительного медиатора ИЛ-1b (табл. 2).
Таблица 2
Содержание цитокинов в сыворотке крови лиц, подвергшихся воздействию малых доз радиации
Цитокины, пг/мл |
здоровые доноры (n=17) |
1 зона (n=38) |
2 зона (n=36) |
3 зона (n=31) |
1, 2, 3 зоны (n=105) |
ИЛ-1b |
7,6 (20,7)*** |
2449,1 (29851,5)*** |
1338,2 (5078,9)*** |
786,2 (6479,6)** |
1204,6 (9785,6)*** |
ФНО-a |
21,5 (38,5) |
19,6 (243,9)* |
1043,9 (11467,8)*** |
1437,4 (5029,7)*** |
280,5 (3270,5)*** |
ИЛ-6 |
5,7 (59,6) |
9,5 (85,9)* |
16,4 (108,2)* |
36,2 (1193,7)* |
6,6 (91,8)* |
ИЛ-2 |
5,8 (19,4) |
119 (316,6)* |
171 (21)* |
220,5 (40)* |
180 (107)* |
ИФН-γ |
0 (19) |
18,9 (423,3)*** |
16,9 (570,4)* |
0 (172,2) |
12,1 (332,6)** |
ИЛ-4 |
6,7 (37,5) |
42,7 (371,7)* |
1,3 (581,1)* |
57,5 (308,5)* |
35,0 (391,3)* |
ИЛ-10 |
14,3 (58,7) |
130,5 (46)*** |
191,0 (204,0)*** |
250,0 (47,5)*** |
178,0 (118)*** |
Примечание:*** - имеется достоверное отличие с группой условно здоровых доноров p<0,001, ** - p<0,01; * - р<0,05. Данные представлены в виде: медиана (размах квартилей)
Содержание других провоспалительных цитокинов - ИЛ-6 и ФНО-a также было повышено в сыворотке крови у всех обследованных групп (табл. 2). При этом, у людей, подвергшихся большему радиационному воздействию (1-я зона), концентрация ФНО-a в сыворотке крови была наименьшей (медиана 19,6 пг/мл). И наоборот, в группе, подвергшейся меньшему радиационному воздействию (3-я зона), концентрация ФНО-a была наибольшей (медиана 1437,4 пг/мл). Снижение сывороточных концентраций ФНО-a у жителей 1-ой зоны совпадает с данными по спонтанной продукции ФНО-a МНК ПК в культуре (табл. 1), которая у жителей 1-ой зоны была минимальной. Сывороточный уровень ИЛ-6 во всех населенных пунктах достоверно превышал нормальные показатели, но незначительно. Полученные нами результаты согласуются с данными о повышении уровня экспрессии мРНК ИЛ-1b, ФНО-a и ИЛ-6 в интактных МНК ПК, полученными ранее на этой же группе обследованных [Козлов В.А., 1995].
Другой группой важных медиаторов, которые были изучены, и от которых в значительной степени зависит развитие иммунной реакции преимущественно по клеточному или гуморальному типу, являются цитокины, продуцируемые Т-хелперными клетками 1-го (Тх1) и 2-го типов (Тх2). В норме существует определенный баланс в продукции этих цитокинов, обеспечивающий функционирование различных звеньев иммунной системы. Изменение в профиле продуцируемых цитокинов свидетельствует об активации иммунной системы и при устойчивых изменениях может указывать на формирование иммунопатологических состояний.
При анализе цитокинов, продуцируемых Тх1, показано, что концентрация ИЛ-2 в сыворотке крови обследованных жителей Угловского района достоверно выше в сравнении с показателями контрольной группы (табл. 2). У лиц из населенных пунктов с различной ЭЭД изменения содержания ИЛ-2 в сыворотке крови имеют сходный характер. Уровень ИФН-g (табл. 2) в сыворотке крови жителей Алтайского края достоверное увеличен в 1, 2 зонах и в совокупности групп в целом в сравнении с группой условно здоровых доноров.
Изучение содержания ИЛ-4 (табл. 2) в сыворотке крови жителей Угловского района Алтайского края обнаружило увеличение концентрации цитокина у всей группы обследованных. При исследовании содержания ИЛ-4 в сыворотке крови лиц, проживающих в отдельных населенных пунктах, в 1-й и 3-й зонах выявлено достоверное увеличение показателя. Во 2-ой зоне, значение медианы ниже, чем у здоровых доноров, но большой размах квартилей свидетельствует о повышенном значении уровне ИЛ-2 у значительного процента обследуемых. Содержание ИЛ-10 в сыворотке крови жителей Алтайского края, подвергшихся радиационному воздействию, как в целом, так и отдельно по населенным пунктам, достоверно увеличено, что аналогично характеру изменений, выявленных для других изученных цитокинов (табл. 2).
Заключение.
Таким образом, на фоне повышенной распространенности иммунопатологических синдромов нами выявлен ряд изменений количественных и функциональных свойств иммунокомпетентных клеток у обследованных. У лиц, подвергшихся радиационному воздействию, наблюдается повышенная пролиферативная активность мононуклеарных клеток и продукция ФНО-a в ответ на митоген, в то же время продукция цитокинов Тх1 и Тх2 типа (ИЛ-2 и ИЛ-4) практически не меняется или даже снижается после активирующего стимула.
В сыворотке крови лиц, подвергшихся радиационному воздействию, выявлено увеличение содержания провоспалительных цитокино ИЛ-1b, ИЛ-6 и ФНО-a, причем наиболее значимые изменения обнаружены для ИЛ-1b. Также выявлено повышение содержания цитокинов, продуцирующихся как Тх-1 (ИЛ-2 и ИНФ-g), так и Тх-2 (ИЛ-4, ИЛ-10) типов, что свидетельствует об активации иммунной системы. Это повышение не столь выражено, как для провоспалительных цитокинов и в определенной степени может быть следствием повышения провоспалительных цитокинов, высокий уровень которых приводит к изменению баланса цитокинов и установление его на другом, более высоком уровне.
С другой стороны, повышенный уровень цитокинов Тх1 и 2 типа в сыворотке крови жителей Угловского района сопровождается ростом частоты встречаемости таких иммунопатологических синдромов как инфекционный, аллергический, аутоиммунный, гематологический, онкологический, в формировании которых участвуют как механизмы клеточного, так и гуморального иммунитета, которые как раз и регулируются изученными нами цитокинами. Повышение частоты иммунозависимых заболеваний у лиц, подвергшихся радиационному воздействию, в патогенезе которых участвуют цитокины Т-хелперов 1-го и 2-го типов, вероятно, является следствием повышения уровня экспрессии и продукции провоспалительных цитокинов и нарушения баланса цитокинов Тх1 и 2 типа.
Можно заключить, что у жителей всех обследованных населенных пунктов, подвергшихся радиационному воздействию в результате деятельности Семипалатинского полигона, выявлены изменения как количественных, так и функциональных параметров иммунокомпетентных клеток периферической крови, причем наиболее значимые отклонения обнаружены у жителей населенного пункта с максимальным значением ЭЭД. Выявленные изменения в субпопуляционной структуре и функциональных свойствах иммунокомпетентных клеток и уровне цитокинов, безусловно, лежат в основе регистрируемого роста частоты встречаемости иммунопатологических синдромов и свидетельствует о глубоких изменениях в иммунной системе.
Литература
1. Гельфгат Е.Л., Тузов М.Ю., Коненков В.И. Методика автоматизированной оценки индивидуального риска иммунопатологических состояний (тест АСИРИС)// Метод. разработка.-Новосибирск, 1990. – 36 с.
2. Козлов В.А., Гуськова Л.В., Сенникова Ю.А Экспрессия генов основных медиаторов иммунной и кроветворной систем у лиц, подвергшихся радиационному воздействию.// Вестник научной программы "Семипалатинский полигон - Алтай", 1995.- N 2.-С.58-64.
3. Шойхет Я.Н., Киселев В.И., Лоборев В.М., Судаков В.В., Алгазин А.И., Лагутин А.А., Зайцев Е.В., Колядо И.Б., Зеленов В.И., Габбасов И.Н., Гончаров А.И. Радиационное воздействие на население Алтайского края ядерных испытаний на Семипалатинском полигоне// Барнаул, 1999. – 345 с.
4. Шойхет Я.Н., Козлов В.А., Коненков В.И., Киселев В.И., Сенников С.В., Колядо И.Б., Алгазин А.И., Колядо В.Б., Зайцев Е.В. Иммунная система населения, подвергшегося радиационному воздействию на следе ядерного взрыва // Барнаул, 2000. – 179 с.
5. Шубик В.М. Состояние иммунитета при радиационных воздействиях.// Гигиена и санитария, 1989. – N 1. – с. 25 – 28.
6. Ярилин А.А. Радиация и иммунитет. // Радиационная биология. Радиоэкология , 1977. – Т. 32. – вып. 4. – с. 597 – 603.
