Е.А. Малиновская
НИИ онкологии Томского научного центра СО РАМН,
Сибирский государственный медицинский университет, г. Томск
На моделях метастазирующих экспериментальных опухолей карциномы легких Льюис (LLC), меланомы В-16, аденокарциномы толстого кишечника (АКАТОЛ) изучена способность гепатопротектора лохеина модулировать рост и метастазирование экспериментальных злокачественных опухолей при монотерапии и в комбинации с низкими терапевтическими дозами циклофосфана. На мышах с LLC и меланомой В-16 показано, что лохеин усиливает антиметастатическую активность циклофосфана, а также повышает его противоопухолевое действие в отношении первичного опухолевого узла LLC. Лохеин обладает и собственной антиметастатической активностью, снижая интенсивность образования и роста метастазов LLC и меланомы В-16 в легких и опухоли АКАТОЛ в печени.
THE STUDY OF THE EFFICACY OF LOKHEIN HEPATOPROTECTOR IN THE COMPLEX THERAPY OF EXPERIMENTAL MALIGNANT TUMORS
E.A. Malinovskaya
Cancer Research Institute, Tomsk
Siberian State Medical University, Tomsk
The ability of Lokhein hepatoprotector to modulate the growth and metastatic spread of experimental malignant tumors when used as a single agent and in combination with low therapeutic doses of cyclophosphane has been studied on the models of metastatic experimental tumors of Lewis´s lung carcinoma (LLC), melanoma B-16, adenocarcinoma of large intestine. Lokhein has been shown to enhance the anti-metastatic activity of cyclophosphane and increase its anti-tumor effect on the primary tumor of LLC- Lokhein has its own anti-metastatic activity reducing the growth intensity of metastases from LLC and melanoma B-16 in lungs and adenocarcinoma of large intestine in the liver.
Одним из путей повышения эффективности терапии злокачественных новообразований является применение модификаторов биологических реакций различной природы — агентов, воздействующих как на опухолевые клетки, так и на регуляторные системы организма, в том числе иммунную, которые обеспечивают противоопухолевую резистентность, а также повышают толерантность организма к цитостатической терапии [2, 3, 7]. Спектр модификаторов биологических реакций включает в себя агенты различной природы с иммуномодулирующей, антиоксидантной, адаптогенной активностью. Несмотря на большое разнообразие модификаторов, в клинической практике их использование ограничено по ряду причин: дороговизна, наличие побочных эффектов, инъекционные способы введения, что делает актуальным поиск новых лекарственных средств, удобных для клинического применения.
В Сибирском медицинском университете разработан оригинальный гепатопротектор лохеин - экстракт солянки холмовой. Терапевтический эффект лохеина обусловлен комплексом биологически активных веществ, важнейшими из которых являются глицинбетаин, флавоноиды, стерины и их гликозиды, каротиноиды, соли органических кислот, алкалоиды. Показано, что в условиях экспериментального острого и хронического гепатита лохеин оказывает антиоксидантное, противонекротическое и антипролиферативное действие, улучшает биоэнергетику, экскреторную и антитоксическую функцию печени. Получены данные о нормализующем влиянии гепатопротекторов на показатели системы иммунитета у животных с хроническим токсическим гепатитом [4, 6]. Принимая во внимание широкий спектр биологической активности лохеина, целесообразным представляется исследование его эффективности в лечении злокачественных опухолей при использовании в сочетании с цитостатическими препаратами.
Целью настоящего исследования была оценка влияния гепатопротектора лохеина на рост и метастазирование экспериментальных злокачественных опухолей при его использовании в комбинации с низкими терапевтическими дозами циклофосфана.
Методика исследований
Эксперименты выполнены на половозрелых мышах линии С57В1/6 массой 20-22 г, полученных из питомника лаборатории экспериментального биомоделирования НИИ фармакологии Томского научного центра СО РАМН (сертификат имеется). Подопытным животным перевивали в мышцу левого бедра гематогенно метастазирующую карциному легких Льюис (LLC) (1 X 106 клеток на животное). Перевивку гематогенно метастазирующей Б легкие меланомы В-16 осуществляли введением взвеси 5 X 106 опухолевых клеток подкожно в бедро левой задней лапы.
Циклофосфамид (ЦФ) инъецировали внутрибрюшинно в дозе 40 мг/кг на 3-й и 7-е сут после перевивки опухоли. Лохеин в оптимальной терапевтической дозе (200 мг/кг в водном растворе) вводили перорально ежедневно, начиная со 2-х сут после перевивки опухоли в течение всего эксперимента. Животные контрольных групп получали перорально эквиобъемное количество воды.
Мышей с LLC и В-16 забивали на 18—20-е сут роста опухоли путем цервикальной дислокации под эфирной анестезией. Извлекали и взвешивали первичные опухолевые узлы, а также легкие. Эффективность противоопухолевой терапии определяли по степени торможения роста опухоли (в %). Учитывали количество животных с метастазами (частота метастазирования), количество метастатических колоний в каждом легком u1080 и их площадь. Для оценки антиметастатической эффективности терапии вычисляли индекс ингабиции метастазирования (ИИМ, %) по формуле:
ИИМ= (А к Х В к - А х В) / АкХВк * ЮО,
где Ак и А — процент мышей с метастазами в контрольной и опытной группах; Вк и В - среднее количество метастазов в легких животных в контрольной и опытной группах.
Торможение роста метастазов (ТРМ, %) оценивали по формуле:
Т Р М = ( К - О ) / К ,
где К и О — средняя площадь метастазов (в мм2) в легких животных контрольной и опытной групп. Метастазы в печень были индуцированы путем внутриселезеночной инъекции 2 X 105 клеток аденокарциномы толстого кишечника (АКАТОЛ) под эфирной анестезией. Лохеин вводили перорально в дозе 200 мг/кг, ежедневно, начиная со дня операции. На 10-е сут после операции мышей забивали, оценивали количество метастазов в печени.
Статистическую обработку результатов осу- ществляли методами вариационной статистики, статистическую значимость различий между группами оценивали с помощью непараметриче- ского критерия Вилкоксона—Манна—Уитни.
Результаты и обсуждение
Эксперименты по модуляции эффективности цитостатической терапии лохеином проводили на гематогенно метастазирующих в легкие опухолях — карциноме легких Льюис (LLC) и меланоме В-16. На мышах с LLC показано, что введение гепатопротектора в течение всего периода роста опухоли совместно с циклофосфаном в низкой терапевтической дозе приводит к более выраженному торможению роста первичного опухолевого узла, чем у животных, получавших монотерапию ЦФ в соответствующей дозе (табл. 1).
Лохеин в сочетании с ЦФ уменьшает частоту метастазирования на 34%, при этом снижение интенсивности метастазирования, оцениваемое по среднему числу метастатических колоний в легких, в 4,3 раза более выражено в этой группе мышей. Интегральным результатом отмеченных изменений явилось значительное увеличение индекса ингибиции метастазирования при сочетанном лечении мышей низкими дозами ЦФ с лохеином до 91%. Также отмечено, что при совместном применении ЦФ с лохеином наблюдается более эффективная ингибиция роста уже образовавшихся метастазов, чем в группе животных, леченных только цитостатиком (табл. 1).
Сходные результаты получены и на модели меланомы В-16: торможение роста первичного опухолевого узла усиливается незначительно при совместном применении ЦФ и лохеина, однако существенно тормозится процесс метастазирования — снижается частота и интенсивность образования метастазов (на 50 и 75% соответственно), торможение роста метастазов усиливается на У.ЭУО по сравнению с группой мышей, получавших только цитостатик (табл. 2).
Следует отметить, что аналогичные результаты были получены нами при использовании лохеина в комбинации с циклофосфаном в дозе 60 мг/ кг для лечения LLC и меланомы В-16 (данные.. не представлены).
Существенное усиление торможения метастазирования при совместном применении циклофосфана и лохеина при отсутствии практического влияния на первичную опухоль свидетельствует о том, что не происходит повышения повреждающего действия ЦФ на опухолевые клетки. Возможной причиной наблюдаемого эффекта может быть самостоятельное прямое либо опосредованное эндогенными механизмами антиметастатическое действие лохеина. Поэтому было исследовано влияние монотерапии лохеином на рост и метастазирование перевиваемых опухолей у мышей.
При монотерапии карциномы легких Льюис лохеин проявляет умеренный ингибирующий эффект на рост первичного опухолевого узла и интенсивность метастазирования (табл.3).
Наблюдается также торможение метастазирования LLC в легкие — индекс ингибиции метастазирования составил 25%. Кроме того, лохеин при самостоятельном применении обладает высокой способностью ингибировать рост уже имеющихся легочных метастатических колоний — индекс торможения роста метастазов был около 70 % (табл.3).
При монотерапии мышей с гделаномой В-16 лохеином показано, что препарат снижает частоту и интенсивность метастазирования опухоли (на 50 и 59% соответственно), также отмеченс торможение роста метастазов (табл. 4).
Поскольку показано, что, по крайней мере частично, фармакологическое действие гепатопротектора лохеина реализуется посредством регуляции функции печени, представлялось целесообразным оценить его влияние на развитие опухолей печени. Известно, что одной из физиологических функций печени является осуществление контроля за мутирующими клетками, но, с другой стороны, именно печень характеризуется высокой частотой распространения метастазов. Мы оценили действие лохеина на модели опухоли аденокарциномы толстого кишечника (АКАТОЛ), трансплантация клеток которой внутриселезеночно приводила к метастазированию в печень. Показано, что лохеин почти двукратно снижает интенсивность метастазирования АКАТОЛ (рис. 1).
Таким образом, гепатопротектор лохеин существенно повышает эффективность антиметастатического действия низких доз циклофосфана, при монотерапии в определенной степени предотвращает появление метастазов в легкие и значительно ингибирует их рост у мышей с перевиваемыми опухолями. По-видимому, способность лохеина влиять на процесс метастазирования связана с активацией этим препаратом эндогенных эффекторов противоопухолевой резистентности и их цитостатическим действием на клетки опухоли, мигрирующие в легкие.
Одним из возможных механизмов наблюдаемого нами повышения терапевтической эффективности ЦФ с помощью ГП может быть его действие на монооксигеназную систему печени, повреждение которой происходит под влиянием злокачественной опухоли [1]. Ранее было показано, что лохеин препятствует конверсии цитохрома Р-450 в каталитически инертную форму Р-420, повышая его стабильность в процессе тепловой инкубации микросом. Кроме того, он повышает активность ферментов II фазы биотрансформации - глутатион-Б-трансферазы и глюкуронил- трансферазы [5].
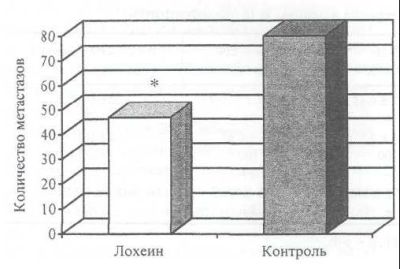
Рис. 1. Влияние лохеина на интенсивность метастазирования аденокарциномы толстого кишечника АКАТОЛ (* - статистически значимые различия с контрольной группой, р<0,05)
Способность лохеина восстанавливать антитоксическую функцию печени, улучшать реакции метаболической биотрансформации, помогая нормальному метаболизму, а следовательно, и терапевтической активности цитостатика и при этом повышать толерантность организма к его токсическому действию [4], очевидно, вносит свой вклад в повышение противоопухолевой эффективности при сочетанном использовании с ЦФ. Терапевтическая активность лохеина как растительного препарата, несомненно, обусловлена наличием комплекса биологически активных компонентов, влияющих на резистентность организма. В этом плане особое значение имеют его антиоксидантные свойства и способность модулировать активность антиоксидантных ферментов, поскольку при злокачественном росте и еще более выраженно при цитостатической терапии наблюдается усиление процессов перекисного окисления липидов, реактивные продукты которого оказывают негативное влияние на функциональное состояние иммунокомпетентных клеток. Эффекторные клетки иммунной системы имеют важнейшее значение в ограничении процесса метастазирования, в этой связи способность лохеина повышать функциональную активность компонентов системы иммунитета может вносить существенный вклад в ингибицию метастазирования опухолей как при моновариантном его использовании, так и в комбинации с циклофосфаном.
Таким образом, полученные нами данные о способности лохеина повышать эффективность цитостатической терапии, проявлять самостоятельное антиметастатическое действие в совокупности с данными других исследователей об антитоксическом, иммунотропном и антиоксидантном действии препарата дают основание рассматривать его как модификатор биологических реакций, что делает актуальным исследование u1077 его эффективности у онкологических больных, получающих цитостатическую терапию.
ЛІТЕРАТУРА
1. Богуш Т.А., Богуш Е.А., Степанов А.А. Современные подходы к повышению эффективности противоопухолевой терапии путем индивидуальной оптимизации лечения и избирательного снижения побочных токсических проявлений цитостатиков // Антибиотики и химиотерапия. 2000. Т. 45, № 1.С. 32-38.
2. Моисеенко В.М., Блинов Н.Н., Хансон К.П. Биоте рапия при злокачественных новообразованиях // Рос. онкол. журн. 1997. № 5. С. 57-59
3. Навашин СМ., Вядро ММ. Модификаторы биологических реакций в терапии злокачественных новообразований // ВИНИТИ. Сер. Онкология. 1989. Т. 21. 186 с.
4. Ратькин А.В. Коррекция гепатопротекторами гепатотоксического действия циклофосфана II Фундаменталь ные проблемы фармакологии. М., 2003. С. 108.
5. Саратиков А.С, Венгеровский А.И. Влияние гепатопротекторов, содержащих фосфолипиды, на зависимую от цитохрома Р-450 антитоксическую функцию печени при экспериментальном токсическом гепатите // Бюл. эксперим. биологии и медицины. 1999. № 4. С. 392-394.
6. Саратиков А.С, Венгеровский А.И., Чучалин B.C. Экстракт солянки холмовой (лохеин) - эффективная защита печени. Томск: STT, 2000.113 с.
7. Хансон К.П., Афанасьев Б.В., Берштейн Л.М. и др. Современные тенденции в развитии биологической терапии злокачественных опухолей // Вопр. онкол. 1996. Т. 42, № 5. С. 7-12.
Поступила 12.11.03




